Alternaria alternata
Introduction
Alternaria est un genre comportant approximativement 50 espèces {813, 816, 3318}. A. alternata est l’espèce la plus fréquemment rencontrée et un des mycètes les plus communs de la flore fongique aéroportée {989, 813}. Alternaria spp. est connu mondialement à la fois comme organisme phytopathogène courant et comme allergène aéroporté; plus particulièrement, l’A. alternata est reconnu comme l’espèce aéroallergène type, et, dans une majorité de cas, les problèmes de santé chez les humains et les animaux ont été associés à cette espèce.
Taxonomie
| Règne | Fungi | Famille | Pleosporaceae |
| Phylum | Ascomycota | Genre | Alternaria |
| Classe | Euascomycetes (ou Dothideomycetes) | Espèce | alternata |
| Ordre | Pleosporales |
Le Comoclathris permunda est la forme sexuée ou télémorphe del’Alternaria alternata et le Lewia sp. est la forme parfaite de plusieurs autres Alternaria sp. {3842}; d’autres genres télémorphes comprennent le Graphyllium et le Pleospora.
Le genre comporte 44 espèces bien étudiées et dont l’identification est établie, mais il se peut qu’il en existe des centaines de plus; de fait, la banque de données universelle de l’Universal Protein Resource (UniProt) rapporte 95 espèces nommées parmi les 433 souches enregistrées {3318}. Certains taxonomistes suggèrent également que l’A. alternata est une espèce représentative d’un complexe d’espèces plutôt qu’une espèce unique, et ce groupe pourrait comprendre plusieurs espèces hétérogènes {816}.
Écologie
Les espèces d’Alternaria sont des mycètes dématiacés cosmopolites fréquemment isolés d’échantillons de plantes, de terre, de nourriture et d’air intérieur. Certaines espèces d’Alternaria sont reconnues en tant que phytopathogènes importants {1635, 725} et comme saprophytes sur plusieurs autres substrats {3729, 725, 816, 1056}. Elles sont omniprésentes dans l’environnement et font partie de la flore fongique courante de tous les continents. De plus, elles sont les agents habituels de la décomposition de la matière végétale. Les spores de l’Alternaria sont aéroportées et sont trouvées dans la terre et dans l’eau ainsi qu’en environnement intérieur. Elles se retrouvent aussi dans une grande proportion des échantillons d’air, mais à des concentrations en deçà de 10 % des décomptes totaux.
Plus de détails
Les Alternaria spp. sont des saprophytes cosmopolites; en plus de se trouver communément sur les plantes, dans la terre et dans l’environnement intérieur, ils sont également présents sur certains matériaux cellulosiques de prédilection (bois en décomposition, pulpe de bois et compost) {725} et parfois sur les aliments ainsi que sur les textiles {1056}. En particulier, l’A. alternata est un pathogène des semences, surtout si ces dernières sont affaiblies {1635, 813}; il peut endommager des céréales et des légumes dans les champs, mais rarement pendant le stockage. Les taches noires sur les tomates, les oignons et les carottes sont souvent le résultat d’une infection par l’Alternaria spp. {725}; ce genre cause aussi la rouille précoce de la pomme de terre et peut infester d’autres plantes.
Cette moisissure est considérée comme une des moisissures aéroportées extérieures les plus importantes, au même titre que le Cladosporium {2644, 2649}; les concentrations maximales sont atteintes à la fin de l’été {2388}. Sa concentration dans l’air extérieur est habituellement supérieure à sa concentration dans l’air intérieur {2216}. Parmi les espèces fongiques trouvées à la surface des feuilles des arbres à Tulsa (Oklahoma), l’Alternaria représentait 4,69 % des mycètes isolés avec une concentration maximale de 7,5 ufc/m³, loin derrière les concentrations de Phoma et de Cladosporium {1281}.
Il est intéressant de noter que plusieurs rapports ont associé le temps orageux à une augmentation des concentrations aéroportées des espèces d’Alternaria; une étude a révélé une association entre la survenue de crises d’asthme après des orages et la sensibilisation à l’Alternaria chez des patients {3878, 1570}.
Aux États-Unis, après que les ouragans Katrina et Rita ont ravagé la côte du golfe de la Louisiane en 2005, des milliers de maisons ont été inondées. À la suite de ces événements, une étude portant sur les moisissures aéroportées a indiqué une forte prévalence des espèces d’Alternaria aussi bien dans les échantillons d’air extérieur (45 %) que dans les échantillons d’air intérieur (20 %) {695}.
En Grèce, sur l’île de Crète, une étude aérobiologique menée sur une période de dix ans a démontré que dix-huit espèces de moisissures, y compris des espèces d’Alternaria, suivaient un patron saisonnier; la prévalence du genre Alternaria était de 6,2 % {162}.
En Australie, dans une ville du New South Wales, la mesure de l’exposition personnelle aux spores présentes à l’extérieur a démontré que l’Alternaria était l’un des taxa les plus fréquents {618}. Au cours de la même étude, le nombre de spores inhalées par des volontaires a également été mesuré; les spores d’Alternaria étaient parmi les plus fréquemment dénombrées.
En Grèce, dans la ville d’Athènes, les spores viables des espèces d’Alternaria représentaient 6,32 % de toutes les spores fongiques aéroportées, et ce genre arrivait au troisième rang, suivant de près les espèces de Cladosporium et de Penicillium, avec une concentration moyenne annuelle de 34 ufc/m³ {1282}.
En Lituanie, un recensement aérobiologique réalisé dans des secteurs urbains a permis d’établir que l’A. alternata était dans le tiers supérieur des quelques centaines d’espèces fongiques aéroportées identifiées, avec une prévalence de 62,99 % {2226}.
Aux Pays-Bas, un autre recensement aérobiologique, effectué cette fois à partir du toit d’un hôpital, a permis d’identifier 21 espèces fongiques : l’Alternaria arrivait au septième rang, mais sa concentration ne représentait que 0,9 % du décompte total, avec une concentration moyenne de 2,2 ufc/m³ {864}.
En Arabie Saoudite, l’étude de la poussière déposée provenant des toits de nombreuses maisons et de taxis a révélé que l’Alternaria était assez prévalent : les décomptes totaux sur les géloses variaient de 5 700 à 6 800 unités formatrices de colonies par gramme de poussière (ufc/g) {930}. Dans le même pays, Kwaasi et al. se sont penchés sur les aéroallergènes prélevés dans de la poussière aéroportée lors de tempêtes de sable : l’Alternaria était l’un des isolats les plus fréquents {1841}.
D’autres études faites dans des conditions semblables ont aussi permis de mesurer de faibles concentrations d’Alternaria, même si ce mycète est assez prévalent : l’Alternaria a été récupéré dans 40 à 70 % des échantillons de poussière en suspension dans l’air prélevés sur le toit de maisons sélectionnées en Égypte : ces résultats faisaient de l’Alternaria la moisissure la plus souvent identifiée dans les échantillons, même si les concentrations n’atteignaient que 3,9 à 8,4 ufc par milligramme de poussière {929}.
Au Japon, une étude comparative des milieux intérieurs et extérieurs a permis de mesurer des concentrations d’Alternaria sp. qui constituait de 22,7 à 48,6 % des mycètes présents en milieu extérieur et seulement de 6,0 à 17,5 % de la flore à l’intérieur de deux appartements de deux édifices de quatre étages {2517}.
Exigences de croissance
L’Alternaria se développe sur une variété de substrats. Il peut croître à des températures de 2 °C à 32 °C (croissance optimale entre 25 et 29 °C) {725, 1056}. Le pH optimal est de 4,0 à 5,4, mais cette espèce peut aussi se développer à des pH allant de 2,7 à 8 {989}. Pour se développer, les Alternaria spp. requièrent une quantité d’eau libre minimale (Aw) variant entre 0,85 et 0,88 selon les espèces {989, 813}; cette exigence en eau fait de l’Alternaria, par définition, un colonisateur secondaire.
Activité de l’eau : Aw = 0,85 à 0,88.
Croissance sur matériaux de construction et en environnement intérieur
La présence de l’Alternaria en milieu intérieur a été rapportée dans le monde entier, aussi bien dans les échantillons d’air que dans les échantillons de surface et de poussière {1584, 1756, 624, 605, 2193, 2388}. Alternaria sp. est un colonisateur secondaire {587} et se développe, dans l’environnement intérieur, sur différents matériaux de construction et substrats. On le retrouve souvent dans la poussière provenant de planchers, de tapis et de matelas; il peut s’établir tant sur les cadres et le mastic humide des fenêtres, les murs et le plafond, le papier peint et les finis de peinture acrylique que dans les humidificateurs et les filtres des systèmes de ventilation; l’Alternaria a également été signalé comme contaminant des textiles (coton, jute, laine), du caoutchouc, des bandes magnétiques, des négatifs, des peintures à l’huile, du papier, des parchemins ainsi que de quelques matériaux synthétiques {989, 3729, 725, 1056}.
Alternaria est un contaminant fréquent dans les bâtiments endommagés par l’eau ou inondés {695, 720}.
Plus de détails
Dans une étude expérimentale ayant trait à la croissance de moisissures sur des panneaux de gypse humides situés dans un environnement intérieur, il est apparu que l’Alternaria était un colonisateur secondaire, puisqu’il a été détecté plus d’un mois après que ce matériau de construction a été mouillé {587}. Après que les ouragans Katrina et Rita ont ravagé la côte du golfe de la Louisiane en 2005, des milliers de maisons ont été inondées, et le recensement des moisissures aéroportées a indiqué une forte présence des espèces d’Alternaria, autant dans les échantillons d’air extérieur (45 %) que dans les échantillons d’air intérieur (20 %) {695}.
Lors d’une étude menée sur 831 domiciles, situés à 75 endroits différents dans l’ensemble des États-Unis, des antigènes d’Alternaria ont été détectés dans la plupart des échantillons de poussière domestique (95-99 %) {1085}.
Au Texas, des échantillons prélevés dans les maisons de 100 patients, présentant principalement des symptômes respiratoires, ont été analysés : les cultures fongiques de ces échantillons ont démontré la présence de l’Alternaria aussi bien que celle de l’Aspergillus, du Penicillium et du Cladosporium dans toutes les maisons {705}. D’autres travaux en santé environnementale, portant sur le domicile ainsi que sur les lieux de travail et de loisir de 130 patients allergiques habitant dans l’État de New York, ont été menés sur une période de 13 mois : 20 espèces de moisissures aéroportées ont été décelées {1821}. Dans cette étude, l’Alternaria était présent dans 44 % des échantillons cultivés, ce qui en faisait le septième mycète en importance.
En revanche, une étude danoise, portant sur 72 échantillons de matériaux de construction contaminés par des moisissures provenant de 23 bâtiments publics, arrive à des conclusions contraires : dans cette étude, l’Alternaria était l’un des mycètes les moins fréquemment rencontrés et se trouvait dans 6 % des échantillons {605}.
En Espagne, des chercheurs ont réalisé une étude environnementale dans 22 maisons de patients pour lesquels un diagnostic d’allergie respiratoire avait été posé. Les prélèvements d’air par dépôt passif, 431 à l’intérieur et 150 à l’extérieur, ont révélé que Alternaria alternata était l’espèce la plus fréquemment isolée : il a été détecté dans 37,1 % des échantillons prélevés à l’intérieur. À l’extérieur, il a été détecté dans 62,6 % des échantillons. De fait, c’était la seule espèce pour laquelle les chercheurs avaient observé une différence entre les prélèvements intérieurs et extérieurs {624}.
En Argentine, des prélèvements effectués dans 49 maisons de Santa Fe ont révélé une prédominance relative de l’Alternaria (8,68 % des échantillons) et un décompte moyen de 39,81 ufc/m³, soit 24,6 ufc/m³ dans les régions urbaines et 63,1 ufc/m³ dans les banlieues {1584}.
Une étude coréenne a permis de mesurer les concentrations des bactéries et des mycètes dans l’air extérieur et intérieur de lieux publics (42 bars, 41 cafés Internet et 44 écoles) {2388}; l’Alternaria était au quatrième rang des espèces dominantes et il était présent dans près de 100 % des sites prélevés (intérieur et extérieur). Par contre, sa concentration variait de non discernable à 100 ufc/m³. À plusieurs endroits, les concentrations intérieures étaient plus élevées que les concentrations extérieures; les auteurs ont postulé que certaines caractéristiques de ces microenvironnements pourraient expliquer cette différence.
Des observations similaires ont été faites dans des régions chaudes du globe. Par exemple, en Arabie Saoudite, des espèces d’Alternaria ont été trouvées dans l’environnement intérieur de ménages de Riyad (entre 33 et 49 ufc/g de poussière domestique) {1756}. En Égypte, ce mycète a été identifié dans 40 % à 56 % des vingt échantillons d’air provenant des cabinets d’aisance d’une université, et ce, à des concentrations variant de 56 à 90 ufc/pétri (exposition de cinq minutes) {2193}.
À Atlanta, Alternaria a également été détecté dans le système de climatisation d’une automobile faisant partie d’un groupe de 29 voitures étudiées {2288}.
Des échantillons d’air, prélevés durant des travaux de rénovation ayant lieu dans un bâtiment de sept étages, ont indiqué que la prévalence d’Alternaria avait augmenté de 4 % au moment des travaux à 13 % après les rénovations; ce mycète était également l’un des genres fongiques les plus abondants, constituant 11,2 % des spores aéroportées (27 ufc/m³) {1790}.
Laboratoire
La manipulation des cultures de ce genre doit se faire en respectant les précautions de laboratoire de base (niveau de biosécurité 2).
Morphologie macroscopique des colonies
L’Alternaria se développe rapidement et vient à maturité en dedans de cinq jours {412}; la colonie atteint un diamètre de 3 à 9 cm lorsqu’elle est incubée à 25 °C pendant 7 jours sur gélose pomme de terre (PGA) {816}. La colonie est plate, duveteuse à laineuse et est recouverte d’hyphes aériens courts et grisâtres devenant noir verdâtre ou brun olive, avec un pourtour plus clair {412}. Le revers de la colonie est en général brun et peut noircir en raison de la production d’un pigment apparenté à la mélanine {412, 816}. Lorsqu’elles sont cultivées sur gélose à l’extrait de malt (MEA) à 25 °C, les colonies atteignent un diamètre de 6 cm en dedans de sept jours et elles sont noires ou grisâtres {989, 725}. Sur gélose pomme de terre (PCA) incubée à 25 °C, elles atteignent un diamètre de 5,5 à 6 cm en dedans de sept jours; le mycélium est hyalin avec des conidies noires ou noir olivâtre {1056}.
Morphologie microscopique
Les hyphes sont septés et dématiacés. Les conidiophores sont courts (40-70 x 3-4 µm), septés, bruns, et ils ont un aspect plus ou moins sinueux (en zigzag). Les conidiophores portent de grandes conidies simples ou ramifiées, ovoïdes ou ellipsoïdes (7-10 x 23-34 µm), segmentées par des cloisons (septa) transversales et longitudinales. Ces conidies peuvent produire des tubes germinatifs. Elles sont fortement pigmentées, mûriformes et à parois lisses ou rugueuses. L’extrémité de la conidie située près du conidiophore est arrondie, tandis que l’extrémité située près de l’apex est effilée, conférant aux conidies leur aspect typique de massue {989, 412, 816}.
Métabolites spécifiques
Composés organiques (incluant les COV)
Aucun composé organique volatil (COV) produit spécifiquement par l’Alternaria, qui serait nocif pour les humains ou les animaux, n’a été rapporté.
Toutefois, dans l’environnement intérieur des bâtiments humides, plusieurs métabolites, y compris des composés organiques volatils microbiens (mCOV), ont été identifiés comme étant communs à plusieurs espèces fongiques. La présence fréquente d’Alternaria dans les bâtiments contaminés pourrait donc contribuer fortement à la concentration globale de ces métabolites à l’intérieur {3717} et à la survenue du syndrome des édifices malsains {2649, 569}.
Quelques enzymes très actives produites par des espèces d’Alternaria, particulièrement des cellulases, décomposent facilement la cellulose des matériaux touchés {725}. Quelques espèces produisent également des protéases et des amylases {989}. La production d’un pigment ressemblant à de la mélanine est une caractéristique d’Alternaria sp.
Mycotoxines
L’Alternaria spp. produit un groupe unique de mycotoxines, comprenant des alternariols, des altenuenes, des altertoxines et de l’acide tenuazonique {989, 813, 725, 603}. Ces mycotoxines peuvent être produites sur des substrats variés (ex. : tomates, pommes, olives, blé, sorgho, graines de tournesol et pacanes). L’acide tenuazonique est une mycotoxine importante qui est également produite par un autre mycète, le Phoma sorghina {715}.
Des matériaux de construction artificiellement contaminés avec une variété de mycètes, dont l’Alternaria sp., ont été étudiés pour leurs propriétés toxiques {603}; dans cette étude, cinq isolats d’Alternaria sur six ont produit de l’alternariol et de l’éther monométhylique d’alternariol (EMA).
Plus de détails
La production de mycotoxines par Alternaria alternata sur des panneaux cartonnés de plafond a été examinée par chromatographie en couche mince et par chromatographie en phase liquide à haute performance (CLHP ou HPLC en anglais). L’alternariol et le EMA ont été trouvés dans des extraits de panneaux de plafond, tandis que les extraits des cultures témoins de chacun des trois isolats sur du riz ont produit ces deux mycotoxines en plus de produire de l’altenuene et de l’altertoxine I.
Sur ces panneaux de plafond, on a pu obtenir une croissance abondante et la production d’une bonne quantité de mycotoxines à des taux d’humidité relative de 84 à 89 % et de 97 %. Dans des études expérimentales, 25 °C semble être la température optimale pour la production de trois toxines (alternariol, éther méthylique d’alternariol et acide alternarique) {3873}; ceci suggère que les conditions de croissance en milieu intérieur pourraient être favorables à la production de ces toxines.
Problèmes de santé
Irritation et inflammation
Dans l’environnement intérieur des bâtiments humides, plusieurs composés organiques (COV), y compris les composés organiques volatils microbiens (mCOV), ont été associés à plusieurs espèces fongiques. Certains de ces composés sont communs à la plupart des espèces fongiques et contribuent probablement à différents problèmes de santé liés à la qualité de l’air intérieur. Toutefois, plusieurs des métabolites fongiques identifiés sont peu réactifs et sont présents en faible concentration dans l’air intérieur {594}.
Alternaria produit quelques-uns des mCOV communs à plusieurs moisissures {2749, 3858, 1840, 3717}, et ses métabolites pourraient contribuer à la survenue des symptômes d’irritation observés dans le syndrome des édifices malsains {2649, 569}. Le profil spécifique complet des mCOV de l’Alternaria alternata n’a pas encore été publié.
Réactions allergiques
Les composants d’Alternaria sont reconnus comme étant des allergènes puissants. L’abondance relativement grande des conidies d’Alternaria dans l’air extérieur et la prévalence de ce mycète dans les maisons contaminées en font l’une des sources d’allergènes fongiques les plus importantes {808, 989, 2285, 39, 2355}. Cet allergène cosmopolite produit une sensibilisation fréquente : selon les régions du monde et les populations étudiées, les taux de prévalence des cuti-réactions positives varient de 3 à 12 % dans la population générale et de 13 à 39,4 % chez les sujets atopiques {3912}. Une étude d’une grande cohorte de patients présentant des symptômes respiratoires (asthme et rhinite allergique) a montré une prévalence de la sensibilisation à Alternaria de 66 % chez les patients ayant une réaction positive à au moins une moisissure {3207}.
En particulier, la sensibilisation à Alternaria alternata est responsable des réactions allergiques de Type I {1635, 2285}, tels la rhinite {648}, l’asthme et la sinusite allergique {3802, 2558, 166}. L’A. alternata est associé à l’exacerbation des crises d’asthme {2641, 1780, 3896, 824, 3904, 3907, 3910} et même à l’apparition de l’asthme {3902}; l’exacerbation des crises d’asthme, au point qu’elles puissent représenter un danger pour la vie, a été associée à l’Alternaria sp. {1085}.
Plus de détails
On a également rapporté que l’Alternaria sp. peut être l’agent étiologique de la rhinosinusite chronique (chronic rhinosinusitis ou CRS) {2558, 1469, 2678}. Lors d’une étude, les chercheurs ont signalé que l’Alternaria était plus fréquemment isolé chez les patients souffrant de rhinosinusite, mais que ce mycète pouvait également être présent chez quelques personnes en bonne santé {2678}. En outre, dans le cas du CRS, la réactivité à l’Alternaria et à d’autres mycètes communs pourrait dépendre d’un autre mécanisme immunologique que celui dépendant des IgE {191, 1469}.
Plusieurs études ont montré une association entre la sensibilisation à l’Alternaria et la gravité des crises d’asthme : de fait, il semble que l’association peut être faite avec la concentration aéroportée d’Alternaria, qui, à son tour, peut être associée aux zones climatiques et aux phénomènes météorologiques {1780, 3878, 1570}. Une étude portant sur les associations à court terme entre les concentrations fongiques quotidiennes en spores et les indicateurs reliés aux exacerbations quotidiennes d’asthme dans une grande population urbaine a été entreprise à Londres au Royaume-Uni {1780}. Les chercheurs ont constaté que, dans un groupe d’enfants de 14 ans et moins, le nombre de sortes de spores, y compris celles de l’Alternaria, était associé à une augmentation du nombre de visites aux services des urgences des hôpitaux; une telle association n’a pas été faite pour les adultes.
Plusieurs études ont été entreprises dans le monde afin de déterminer la prévalence de la sensibilisation à l’Alternaria, résultant d’une exposition extérieure ou intérieure. Dans la population générale, entre 3 et 4 % des patients examinés aux États-Unis et en Scandinavie auraient eu une réaction positive aux allergènes d’Alternaria {1635}. Lorsqu’on étudie les patients allergiques, les prévalences sont souvent de cinq à dix fois plus élevées.
Aux États-Unis, les tests intradermiques aux allergènes spécifiques d’Alternaria ont donné des résultats positifs chez 34,5 % des patients asthmatiques comme cela est indiqué dans une étude portant sur 12 106 patients {2640}. Une étude faite au Kansas (États-Unis) a montré une association entre la concentration moyenne élevée de quelques mycètes, y compris celle de l’Alternaria, et des symptômes de santé respiratoire (compilés au moyen d’un questionnaire sur la santé) {1814}. Une étude de la qualité de l’air intérieur, menée aux États-Unis par le National Institutes of Health (NIH) dans le cadre du programme National Survey of Lead and Allergens in Housing {995}, avait pour but d’évaluer l’association entre la contamination intérieure par l’Alternaria et l’asthme; l’étude d’échantillons provenant de 831 domiciles, habités par 2 456 individus, a permis de constater que la prévalence de l’asthme symptomatique croissait avec l’augmentation des concentrations d’Alternaria {648}.
Dans les pays européens, la prévalence de la sensibilisation à l’Alternaria varie typiquement entre 3 et 30 % {2544}. Lors d’une étude portant sur 105 patients asthmatiques traités en Pologne, Niedoszytko et al. {1585} ont constaté que 24 % de ces patients avaient eu une réaction positive au test intradermique à l’Alternaria comparativement à 13 % des témoins; toutefois, dans cette étude, l’exacerbation des symptômes d’asthme a été la plupart du temps associée à d’autres moisissures. En Grèce, sur l’île de Crète, une étude aérobiologique de 10 ans a démontré que, parmi les 571 patients atopiques, la sensibilisation à l’Alternaria (confirmée par intradermoréaction) était la plus fréquente (11,9 %) {162}. Une autre étude menée en Grèce a examiné la sensibilisation de patients aux spores fongiques de 5 espèces, incluant l’Alternaria, par épreuve intradermique : 13,5 % des 1 311 patients examinés ont eu une réaction positive à ce mycète, ce qui était le taux le plus élevé parmi les 5 espèces étudiées {1788}.
Composés et mécanismes allergènes
Les très nombreuses études biochimiques et modèles physiopathologiques des propriétés allergènes de l’Alternariareflètent l’importance de ce mycète omniprésent. Les allergènes principaux de l’A. alternata ont été isolés, et treize fractions ont été bien caractérisées; il a été démontré que les conidies d’A. alternata, peu importe l’endroit où elles ont été isolées dans le monde, contiennent toujours les mêmes allergènes.
La fraction allergène principale est le « Alt-1 » : cet allergène est responsable de 98 % des sensibilisations à Alternaria alternata {2642}. Les moisissures étroitement apparentées, tels le Cladosporium herbarum et l’Ulocladium sp., contiennent quelques fractions allergènes identiques à celles de l’A. alternata {725, 3760, 3912}.
Au moins 35 espèces d’Alternaria, autres que l’A. alternata, ont été caractérisées comme allergènes; l’étude de ces espèces démontre la présence de réactions croisées à l’intérieur du phylum {3912}.
Les mécanismes immunologiques se terminant par la production d’IgE dirigés contre l’Alternaria ont fait l’objet de recherches intensives {2642, 3799, 3877, 3905, 2676, 3911}.
Plus de détails
Des études suggèrent que quelques pathologies pourraient découler de mécanismes commandés à la fois par des IgE et des IgG. Le mécanisme cellulaire a été étudié in vitro chez des patients souffrant de rhinosinusite chronique (CRS) : une immunité spécifique antifongique caractérisée par la présence d’IgG3 dans le sérum, et non pas par la présence d’IgE, permettait de distinguer les patients atteints de CRS faisant partie du sous-groupe des producteurs de mucus éosinophilique (EMCRS) du groupe témoin, et ce, sans égard à la présence d’éléments fongiques dans le mucus ou d’une allergie systémique. Les réponses allergiques spécifiques antifongiques commandées par les IgE chez les patients du groupe EMCRS ne différaient nullement des réactions allergiques des sujets allergiques aux moisissures : ceci remet en question la présomption d’un mécanisme unique dans la sinusite fongique allergique {1481, 191}.
Quelques pathologies peuvent être le résultat d’une exposition combinée à Alternaria et à des bactéries. Par exemple, chez les patients présentant une rhinosinusite à Alternaria, les extraits fongiques entraînent, à eux seuls, des changements minimes en ce qui concerne les concentrations des cytokines dans les lymphocytes du sang périphérique. Cependant, la présence du « superantigène staphylococcique B » (SEB) augmente significativement l’expression de l’interféron gamma (IFN-γ), et cet effet est davantage augmenté par l’ajout combiné de SEB et d’extraits fongiques au milieu de culture {2650}.
Pneumonite d'hypersensibilité
La pneumonite d’hypersensibilité de Type III attribuable aux espèces d’Alternaria est bien connue; notamment en environnement rural, l’Alternaria a été associé à la maladie nommée poumon du fermier {2919, 3938, 3942}.
De plus, l’exposition à des aérosols provenant d’humidificateurs contaminés par de l’Alternaria et par d’autres moisissures a souvent été rapportée comme étant la cause d’une pneumonite aussi appelée poumon des humidificateurs {3010, 277}. Il se pourrait même qu’il y ait des pneumonites à Alternaria survenant à la suite d’expositions à ce mycète dans des bâtiments contaminés par ce dernier {1675, 3593}.
Certaines expositions menant à des pneumonites à Alternaria ont été associées à des milieux de travail spécifiques tels que la foresterie. Dans ce milieu, des pneumonites ont été rapportées, particulièrement chez les travailleurs du bois s’occupant de l’écorçage et de la préparation de la pulpe {3940}.
Effets toxiques (mycotoxicoses)
L’ingestion des toxines d’Alternaria a été mise en cause dans certains problèmes de santé chez l’animal et chez l’homme {3748}, mais très peu de cas ont été rapportés dans la littérature. Les quelques rapports concernant les mycotoxicoses engendrées par l’ingestion de toxines d’Alternaria incriminent des céréales contaminées; l’hypothèse suggérant que des mycotoxicoses puissent être entraînées par l’inhalation de spores d’Alternaria a suscité de nombreuses études qui, pour l’instant, n’ont pas complètement élucidé ce mode d’exposition.
Les recensements réalisés jusqu’à présent démontrent que la prévalence des toxines d’Alternaria dans les aliments est faible, ce qui fait qu’il n’y a, pour l’instant, aucun seuil limite officiel.
Plus de détails
En Allemagne, des éclosions de mycotoxicoses chez des animaux de ferme ont été associées à la contamination de céréales par des toxines d’Alternaria. De plus, la contamination des grains de céréales par des mycotoxines pourrait constituer une piste sérieuse pour la compréhension de l’étiologie de la maladie de Kashin-Beck (KBD). Un métabolite non identifié produit par l’Alternaria a été décelé dans des échantillons de grains d’orge provenant des fermes de familles malades {3847}; toutefois, le rôle joué par l’Alternaria pourrait être seulement secondaire, tandis que le Trichothecium roseum et le Dreschlera sp. sembleraient associés plus étroitement à cette maladie (KBD) {1838}.
Des dommages pulmonaires aigus associés au milieu de travail ont été attribués à l’Alternaria alternata en phase aiguë du syndrome toxique aux poussières organiques (ODTS) {2672}.
La mycotoxicose acquise par inhalation, causée par l’Alternaria, n’a pas encore été confirmée. Toutefois, la présence de symptômes aux voies respiratoires inférieures chez les enfants vivant dans des milieux contaminés par les moisissures a été bien documentée. Pour l’instant, il n’est pas certain que ces expositions aux toxines fongiques soient à l’origine de ces symptômes.
Quelques auteurs proposent que ces maladies des voies respiratoires inférieures chez les enfants et certains cas du syndrome du bâtiment malsain pourraient être en partie attribuables aux composants fongiques d’Alternaria (glucanes et protéines) et à leurs mycotoxines ; toutefois, les mécanismes exacts de ces affections demeurent inconnus {1087}.
Cependant, plusieurs études expérimentales ont été entreprises in vitro au niveau cellulaire ou sur des modèles animaux, et les chercheurs ont pu caractériser les propriétés toxiques de ces métabolites de l’Alternaria.
Les toxines de l’Alternaria sont cytotoxiques in vitro pour les lignées cellulaires de mammifères et pour les cellules bactériennes; elles sont aussi tératogènes et toxiques pour les fœtus de souris et de hamsters. De plus, ces toxines sont reconnues pour bloquer la synthèse des sphingolipides {1635}.
Deux isolats d’Alternaria sp. se sont révélés hépatotoxiques lors d’essais en laboratoire sur des souris; cependant, dans la même étude, d’autres souches n’ont montré aucune toxicité {1771}. Une autre étude a examiné l’activité ciliostatique des endométabolites et des exométabolites extractibles de cinq souches de mycètes filamenteux isolées à partir de prélèvements effectués dans les murs moisis d’un logement; les résultats ont prouvé que les espèces d’Alternaria pouvaient produire des composés possédant une activité ciliostatique très élevée sur les cellules de trachée de poussins {1840}.
Les alternariols et les altenuenes sont faiblement toxiques pour les souris et sont cytotoxiques in vitro sur des lignées cellulaires humaines, et ce, à des concentrations de 6 à 28 µg/ml. Les altertoxines ainsi qu’un composé apparenté également produit par Alternaria, la stemphyltoxine III, sont mutagènes {3929}.
Le mécanisme toxique de l’acide tenuazonique semble être celui d’une inhibition de la synthèse protéinique : plus précisément, cette toxine empêcherait les protéines nouvellement formées de se détacher des ribosomes sur lesquels elles ont été formées {3748, 3483}.
Infection et colonisation
L’infection à Alternaria est rarement rapportée, mais elle ne peut plus être considérée comme rare. Les espèces d’Alternaria sont des microbes pathogènes opportunistes émergents affectant surtout des patients immunosupprimés, tels des receveurs de greffes ainsi que des patients souffrant de malignités hématologiques et d’autres cancers {3808, 2671, 1792, 2031, 3930, 3931}. Chez ces patients immunosupprimés, une simple colonisation peut évoluer et devenir une maladie envahissante {816}.
L’Alternaria alternata peut causer des infections respiratoires aux voies supérieures chez des personnes atteintes du sida {3809}.
L’Alternaria sp. est considéré comme un des agents étiologiques de la phaeohyphomycose {2865}. Plusieurs articles rapportent des cas d’onychomycoses, de sinusites, d’infections cutanées et sous-cutanées ulcérées et de kératites aussi bien que des cas d’infections profondes des tissus mous et d’ostéomyélites attribuables à Alternaria sp. {2645, 3671, 3818, 3807, 3817, 166, 3800, 2674, 3932, 3821, 2683, 2684, 3832, 1598, 3811}.
Plus de détails
Chez des patients immunocompétents, l’Alternaria peut coloniser les sinus paranasaux, et cette colonisation peut mener à une sinusite hypertrophique chronique. Chez les patients immunocompromis, la colonisation peut mener au développement d’une maladie envahissante {3805}.
La colonisation et l’infection fongiques de l’œil par des espèces d’Alternaria ont été rapportées après des interventions chirurgicales, mais l’incidence de ces événements est très limitée {2643, 2684}. L’infection se propageant jusqu’au cerveau a été décrite dans des cas extrêmement rares {725}.
Les onychomycoses constituent jusqu’à 50 % des infections des ongles; elles sont le plus souvent provoquées par des champignons dermatophytes. Cependant, d’autres champignons peuvent être mis en cause; une étude portant sur 88 cas d’onychomycose probable a démontré que l’Alternaria sp. était responsable de 16,6 % des cas {2683}. L’alternariose cutanée ne peut plus être considérée comme une infection fongique rare {2685}; quelques cas de phaeohyphomycose sous-cutanée provoqués par l’Alternaria ont été rapportés {2674, 2681}; un cas de phaeohyphomycose de la muqueuse buccale a également été décrit {2647}.
Facteur de virulence
Aucun facteur particulier de virulence n’a été rapporté. Des lésions sous-cutanées importantes et des infections des ongles sont associées à l’Alternaria, même si la plupart des espèces ne se développent pas à 37 °C {813}.
Milieux particuliers
Infections nosocomiales
Alternaria sp. a été trouvé en milieu hospitalier {313, 386}, mais aucun cas confirmé d’infection nosocomiale dû à l’Alternaria n’a été rapporté dans la littérature. Cependant, quelques auteurs considèrent que les infections opportunistes attribuables àAlternaria pourraient devenir un problème émergent pour les patients immunocompromis en milieu de soins {366, 1747}.
Plus de détails
Lors d’importants travaux de démolition et de rénovation dans un grand hôpital de soins tertiaires, des échantillons d’air et de poussière provenant des conduites de ventilation ont été prélevés et cultivés afin d’assurer la surveillance de l’Aspergillus : les cultures de 74 échantillons ont indiqué également la présence d’Alternaria sp. dans les échantillons d’air intérieur à une concentration moyenne de 0,79 ufc/m³ (comparativement à une concentration moyenne de 8,04 ufc/m³ à l’extérieur) {313}.
Dans une autre étude menée dans sept hôpitaux de l’ouest des États-Unis, l’analyse de onze filtres à air (choisis à cause de leurs signes de décoloration) de systèmes de chauffage, de ventilation et de climatisation (CVC), a révélé que les filtres de trois des sept hôpitaux étaient contaminés par l’A. alternata {386}.
Maladies professionnelles
En milieu de travail, l’Alternaria sp. a été associé à l’asthme professionnel chez les boulangers {2001, 2401, 2989} et a été associé au syndrome toxique aux poussières organiques (ODTS) chez les manutentionnaires travaillant dans le secteur du coton {2672}. En milieu agricole ainsi que dans les centres de compostage et les centres de traitement des eaux usées {855}, les concentrations élevées d’Alternaria sur la matière végétale ou dans les eaux résiduelles pourraient constituer un risque de réactions allergiques de Type I ainsi qu’un risque d’affections pulmonaires allergiques de Type III (pneumonite d’hypersensibilité (HP), poumon du fermier) {1822, 1777, 725, 2658, 1778, 2680}. L’inhalation des spores d’Alternaria sp. pourrait également être associée aux pneumonites d’hypersensibilité appelées alvéolite du travailleur du bois et poumon des cribleurs de pommes de terre {813}.
Occasionnellement, les ouvriers manipulant de la matière végétale pourraient courir un risque accru de développer des infections superficielles en raison de l’introduction possible de l’Alternaria dans les abrasions de la peau ou les blessures par piqûre {2546}.
Plus de détails
L’asthme des boulangers est associé à l’inhalation de conidies d’Alternaria présentes dans la farine; Orman et al. ont rapporté que 4,1 % des ouvriers des boulangeries de type industriel et 3,2 % des ouvriers des boulangeries de type artisanal ont des résultats positifs au test intradermique effectué avec des antigènes d’Alternaria {2001}. Ce mycète a également été trouvé dans des échantillons d’air d’une boulangerie rurale en Inde, en concentration modérée, soit entre 7,3 et 86,7 ufc/m³, sauf pendant le mois de juillet dans la section de l’emballage. Au cours de ce mois, la concentration du mycète atteignait 2 033 ufc/m³ {2401}. Lors d’une autre étude menée dans des boulangeries de type industriel ou de type artisanal (domestique), la prévalence de l’Alternaria variait entre 1,1 et 5,8 % {2001}.
Un cas grave de syndrome toxique aux poussières organiques (ODTS) a été rapporté chez un ouvrier du coton, qui a été exposé à de la poussière de coton naturel pendant trois semaines {2672}; ce cas d’ODTS a été associé à la contamination du coton par l’Alternaria alternata. Une autre étude, portant sur des échantillons de coton provenant de plusieurs régions du monde, avait pour but d’analyser le contenu de ces échantillons et de comprendre leur rôle dans l’ODTS : à l’opposé des études antérieures, cette étude a permis de déceler de l’Alternaria sp. (contaminant mineur) dans un échantillon provenant d’un seul pays, mais elle n’a pas permis d’identifier cette moisissure comme source probable des problèmes de santé professionnelle des ouvriers du coton {700}.
En région rurale, les espèces fongiques constituent la majeure partie des contaminants environnementaux dans les bâtiments où des animaux sont logés {1778, 2331}. Lors d’une étude slovaque, l’A. alternata a été trouvé dans 20 % des échantillons de farines destinées à la volaille {1778}.
En Lituanie, Alternaria sp. a été isolé dans l’environnement intérieur d’un poulailler; ce genre représentait de 2,1 à 5,5 % de toutes les espèces cultivées {854}. Dans une grande étable hébergeant du bétail, en Inde, la prévalence de l’Alternaria alternata dans les échantillons d’air était faible (0,48 à 2,0 %), avec des concentrations allant jusqu’à 52 ufc/m³ {2373}. Par contre, dans une autre étude indienne, l’Alternaria était fréquemment rencontré dans les bâtiments servant au stockage du grain {1777}.
Ces nombreuses études soulignant la présence de l’Alternaria en milieu rural suggèrent que cette moisissure pourrait augmenter les risques que les ouvriers de ferme développent des problèmes respiratoires : de fait, rares sont les articles qui confirment ce risque. Deux cas du poumon du fermier (réaction à IgG) attribuables à l’Alternaria ont été rapportés {725}. Chez des ouvriers agricoles, l’Alternaria a aussi été identifié en tant qu’agent étiologique d’otites de l’oreille moyenne; ces infections ont été directement associées au type de travail des sujets touchés {3933}.
La concentration aéroportée de ce mycète a aussi été associée à la transformation de la menthe poivrée et de la camomille sur les sites de production {2680} et lors du procédé de raclage des fibres de lin {2658}.
L’Alternaria alternata est une moisissure qui s’établit bien dans les usines municipales de traitement des eaux usées : une étude polonaise a permis de le relever dans 10,4 % des échantillons {855}.
Dans les serres, A. alternata peut être trouvé sur des plantes affaiblies ou mortes {725}. Une étude ayant trait à la qualité de l’air intérieur des serres ainsi que des logements abritant des plantes d’intérieur a indiqué qu’Alternaria était la moisissure dominante avec une prévalence variant de 52 à 82 % dans ces mêmes logements et de 80 à 100 % dans les échantillons provenant des serres d’un jardin botanique {1822}.
De plus, Flournay et al. ont rapporté que l’Alternaria était la moisissure la plus fréquemment isolée à partir des épines de roses (45 isolats) {2546}; les rosiers sont notoirement susceptibles aux maladies fongiques et peuvent agir en tant que véhicules importants dans la transmission des microorganismes pathogènes par les piqûres.
En dentisterie, les embouts à main sont une source reconnue d’aérosol microbien. Lors d’une recherche conduite dans 25 cliniques dentaires, les chercheurs ont relevé une concentration de 24,8 ufc/m³ d’A. alternata avant la désinfection et de 16,4 ufc/m³ après un procédé de désinfection standard. L’A. alternata arrivait en deuxième place parmi les espèces identifiées et constituait près de 13 % des décomptes totaux {2396}.
Dans une étude portant sur l’association entre des symptômes respiratoires éprouvés par 214 employés de bureau et la sensibilisation allergique (mesurée par cuti-réaction) : les résultats ont établi que des symptômes respiratoires sont sensiblement associés à l’exposition aux allergènes d’Alternaria détectés dans les systèmes de chauffage, de ventilation et de climatisation (CVC) {2666}.
Les travaux de rénovation et de modification des conduites de ventilation dans des bâtiments peuvent entraîner une décharge élevée de spores, viables et non viables, dans l’air. L’analyse des échantillons d’air prélevés dans un bâtiment de sept étages, faisant l’objet de travaux de rénovation, a démontré que l’Alternaria a été trouvé plus souvent avant les travaux (4 %) qu’après ces derniers (13 %); cette moisissure était également l’un des genres fongiques les plus abondants, constituant 11,2 % des spores aéroportées totales (27 ufc/m³) {1790}.
Outils de diagnostic
Cultures
Puisque les espèces d’Alternaria sont cosmopolites et omniprésentes dans la nature, elles sont également des contaminants communs en laboratoire. Ainsi, leur présence dans une culture exige une évaluation prudente {1819}. La présence d’Alternaria dans les sécrétions des sinus peut être compatible avec un diagnostic de rhinosinusite chronique, mais peut être également une observation fortuite {2678}.
Histopathologie
Dans les sections de tissus infectés, on observe des hyphes filamenteux foncés, lorsqu’ils sont colorés à l’hématoxyline-éosine (H & E). Une coloration argentique de Fontana-Masson, coloration spécifique de la mélanine, peut être appliquée dans les cas où la coloration H & E ne met pas bien en évidence la pigmentation des hyphes {816}.
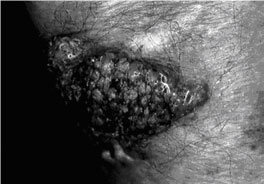
Lésion végétative à l’avant-bras, à surface mamelonnée, provenant d’une lésion sous-cutanée à Alternaria alternata {2674} .
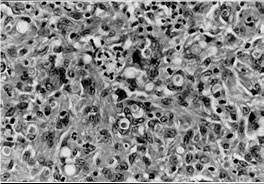
Une réaction inflammatoire granulomateuse du derme, incluant des structures fongiques de l’A. alternata, (acide périodique Schiff appliqué après digestion à la diastase, X 1 700) {2674} .
Immunodiagnostic
Les réactifs nécessaires aux épreuves in vivo et in vitro sont disponibles commercialement et peuvent parfois être utiles pour établir une association entre une réaction allergique (IgE) ou une pneumonite d’hypersensibilité (IgG) et une exposition à Alternaria sp.
Les extraits allergènes d’Alternaria font partie des trousses immunodiagnostiques de base sous présentation d’allergènes simples ou contenus dans certains mélanges {3284, 581}.
Les préparations d’allergènes sont disponibles commercialement pour usage in vivo ou in vitro : des extraits d’Alternaria sp. pour les examens in vivo (épreuves intradermiques) et « l’Alternaria alternata Alt-1 » pour les épreuves in vitro (RAST).
Plus de détails
Les antigènes d’Alternaria font partie du programme américain de surveillance de la Federal Drug Administration (FDA) des États-Unis et du Biological Products Deviation Reporting. Non-Blood Product Codes (registre des substances biologiques fongiques recevant les rapports concernant la non-conformité de produits [traduction libre]) {3285}.
GJ06 - Alternaria solani
GJ07 - Alternaria tenuis (alternata)
Liste constituée à partir du registre de l’année 2008 de la Federal Drug Administration (FDA), qui permet de faire le suivi des substances biologiques homologuées, soit le Biological Products Deviation Reporting. Non-Blood Product Codes {3285}.
Épreuves immunodiagnostiques disponibles
| Épreuve | IgE | IgG | Antigènes | Autre |
|---|---|---|---|---|
| Cuti-réactions | X | |||
| RAST-IgE | X | |||
| RAST-IgG | X | |||
| ELISA-ELIFA | ||||
| Immunodiffusion | N/D | |||
| Immunofluorescence | N/D | Expérimental | ||
| Fixation du complément | N/D | |||
| PCR | Expérimental | |||
| Autre |
Bibliographie
- 39. Horner, W. E. (2003). Assessment of the indoor environment: evaluation of mold growth indoors. Immunol.Allergy Clin North Am.2003.Aug.;23(3):519.-31. 23, 519-531.
- 162. Guneser, S., Atici, A., Koksal, F., and Yaman, A. (1994). Mold allergy in Adana, Turkey. Allergol.Immunopathol.(Madr.). 22[2], 52-54.
- 166. Manning, S. C., Schaefer, S. D., Close, L. G., and Vuitch, F. (1991). Culture-positive allergic fungal sinusitis. Arch Otolaryngol.Head Neck Surg. 117[2], 174-178.
- 191. Pant, H., Kette, F. E., Smith, W. B., Wormald, P. J., and Macardle, P. J. (2005). Fungal-specific humoral response in eosinophilic mucus chronic rhinosinusitis. Laryngoscope. 115[4], 601-606.
- 277. Baur, X., Richter, G., Pethran, A., Czuppon, A. B., and Schwaiblmair, M. (1992). Increased prevalence of IgG-induced sensitization and hypersensitivity pneumonitis (humidifier lung) in nonsmokers exposed to aerosols of a contaminated air conditioner. Respiration. 59[4], 211-214.
- 313. Curtis, L., Cali, S., Conroy, L., Baker, K., Ou, C. H., Hershow, R., Norlock-Cruz, F., and Scheff, P. (2005). Aspergillus surveillance project at a large tertiary-care hospital. J Hosp.Infect. 59[3], 188-196.
- 366. Groll, A. H. and Walsh, T. J. (2001). Uncommon opportunistic fungi: new nosocomial threats. Clin Microbiol Infect. 7 Suppl 2:8-24., 8-24.
- 386. Simmons, R. B., Price, D. L., Noble, J. A., Crow, S. A., and Ahearn, D. G. (1997). Fungal colonization of air filters from hospitals. Am Ind.Hyg.Assoc.J. 58[12], 900-904.
- 412. Larone, D H. (1987). Medically important fungi. A guide to identification. 2nd edition, -230 p. New York - Amsterdam - London, Elsevier Science Publishing Co., Inc.
- 569. McGrath, J. J., Wong, W. C., Cooley, J. D., and Straus, D. C. (1999). Continually measured fungal profiles in sick building syndrome. Curr.Microbiol. 38[1], 33-36.
- 581. Pharmacia Diagnostics AB. (2007). Allergy & autoimmunity. Diagnostics product catalogue 2007. internet , 1-48. Pharmacia.
- 587. Krause, M., Geer, W., Swenson, L., Fallah, P., and Robbins, C. (2006). Controlled study of mold growth and cleaning procedure on treated and untreated wet gypsum wallboard in an indoor environment. J Occup.Environ Hyg. 3[8], 435-441.
- 594. Claeson, A. S., Levin, J. O., Blomquist, G., and Sunesson, A. L. (2002). Volatile metabolites from microorganisms grown on humid building materials and synthetic media. J Environ Monit. 4[5], 667-672.
- 603. Nielsen, K. F., Gravesen, S., Nielsen, P. A., Andersen, B., Thrane, U., and Frisvad, J. C. (1999). Production of mycotoxins on artificially and naturally infested building materials. Mycopathologia. 145[1], 43-56.
- 605. Gravesen, S., Nielsen, P. A., Iversen, R., and Nielsen, K. F. (1999). Microfungal contamination of damp buildings--examples of risk constructions and risk materials. Environ Health Perspect. 107 Suppl 3:505-8., 505-508.
- 618. Green, B. J., O'meara, T., Sercombe, J., and Tovey, E. (2006). Measurement of personal exposure to outdoor aeromycota in northern New South Wales, Australia. Ann Agric.Environ Med. 13[2], 225-234.
- 624. de Ana, S. G., Torres-Rodriguez, J. M., Ramirez, E. A., Garcia, S. M., and Belmonte-Soler, J. (2006). Seasonal distribution of Alternaria, Aspergillus, Cladosporium and Penicillium species isolated in homes of fungal allergic patients. J Investig.Allergol.Clin Immunol. 16[6], 357-363.
- 648. Salo, P. M., Arbes, S. J., Jr., Sever, M., Jaramillo, R., Cohn, R. D., London, S. J., and Zeldin, D. C. (2006). Exposure to Alternaria alternata in US homes is associated with asthma symptoms. J Allergy Clin Immunol. 118[4], 892-898.
- 695. Rao, C. Y., Riggs, M. A., Chew, G. L., Muilenberg, M. L., Thorne, P. S., Sickle, D. V., Dunn, K. H., and Brown, C. (2007). Characterizing airborne molds, endotoxins and glucans in homes in New Orleans after Hurricanes Katrina and Rita. Appl.Environ Microbiol. .
- 700. Lane, S. R. and Sewell, R. D. (2006). The fungal profile of cotton lint from diverse sources and implications for occupational health. J Occup Environ Hyg. 3[9], 508-512.
- 705. Rea, W. J., Didriksen, N., Simon, T. R., Pan, Y., Fenyves, E. J., and Griffiths, B. (2003). Effects of toxic exposure to molds and mycotoxins in building-related illnesses. Arch Environ Health. 58[7], 399-405.
- 715. Fiedler, K., Schutz, E., and Geh, S. (2001). Detection of microbial volatile organic compounds (MVOCs) produced by moulds on various materials. Int J Hyg.Environ Health. 204[2-3], 111-121.
- 720. Taskinen, T., Meklin, T., Nousiainen, M., Husman, T., Nevalainen, A., and Korppi, M. (1997). Moisture and mould problems in schools and respiratory manifestations in schoolchildren: clinical and skin test findings. Acta Paediatr. 86[11], 1181-1187.
- 725. Gravesen, S., Frisvad, J. C., and Samson, RA. (1994). Microfungi. 1st edition, -168 p. Copenhagen, Munksgaard.
- 808. Al-Doory, Y and Domson, JF. (1984). Mould allergy. Lea & Febiger.
- 813. EMLAB. (2007). Environmental Microbiology Laboratory, Inc. (EMLab): An index of some commonly encountered fungal genera.
- 816. Patterson, T. F., McGinnis, M. R., and ed. (2009). The fungi :description. Site Doctor Fungus . Mycoses Study Group.
- 824. Denning, D. W., O'Driscoll, B. R., Hogaboam, C. M., Bowyer, P., and Niven, R. M. (2006). The link between fungi and severe asthma: a summary of the evidence. Eur Respir.J. 27[3], 615-626.
- 854. Lugauskas, A., Krikstaponis, A., and Sveistyte, L. (2004). Airborne fungi in industrial environments--potential agents of respiratory diseases. Ann Agric.Environ Med. 11[1], 19-25.
- 855. Prazmo, Z., Krysinska-Traczyk, E., Skorska, C., Sitkowska, J., Cholewa, G., and Dutkiewicz, J. (2003). Exposure to bioaerosols in a municipal sewage treatment plant. Ann Agric.Environ Med. 10[2], 241-248.
- 864. Beaumont, F., Kauffman, H. F., de Monchy, J. G., Sluiter, H. J., and de Vries, K. (1985). Volumetric aerobiological survey of conidial fungi in the North-East Netherlands. II. Comparison of aerobiological data and skin tests with mould extracts in an asthmatic population. Allergy. 40[3], 181-186.
- 929. Abdel-Hafez, S. I., Shoreit, A. A., Abdel-Hafez, A. I., and el Maghraby, O. M. (1986). Mycoflora and mycotoxin-producing fungi of air-dust particles from Egypt. Mycopathologia. 93[1], 25-32.
- 930. Abdel-Hafez, S. I. and Shoreit, A. A. (1985). Mycotoxins producing fungi and mycoflora of air-dust from Taif, Saudi Arabia. Mycopathologia. 92[2], 65-71.
- 989. Centre de recherche sur la conservation des documents graphiques. (2007). Moisissures et biens culturels. Ministère de la culture et de la Communication, France .
- 995. Integrated Laboratory Systems. (2004). Stachybotrys chartarum (or S. atra or S. alternans) [CAS No. 67892-26-6]; Review of Toxicological Literature. National Institute of Environmental Health Sciences (NIEHS). 1-66. United States.
- 1056. Samson, RA, Hoekstra, ES, and Frisvad, JC. (2004). Introduction to food and airbone fungi. 7th, -389 p. Baarn, Centralalbureau voor Schimmellcultures, Institute of the Royal Netherlands Academy of Arts and Sciences.
- 1085. Salo, P. M., Yin, M., Arbes, S. J., Jr., Cohn, R. D., Sever, M., Muilenberg, M., Burge, H. A., London, S. J., and Zeldin, D. C. (2005). Dustborne Alternaria alternata antigens in US homes: results from the National Survey of Lead and Allergens in Housing. J Allergy Clin Immunol. 116[3], 623-629.
- 1087. Stark, P. C., Burge, H. A., Ryan, L. M., Milton, D. K., and Gold, D. R. (2003). Fungal levels in the home and lower respiratory tract illnesses in the first year of life. Am J Respir.Crit Care Med. 168[2], 232-237.
- 1281. Levetin, E. and Dorsey, K. (2006). Contribution of leaf surface fungi to the air spora. Aerobiologia 22[1], 3-12.
- 1282. Pyrri, I. and Kapsanaki-Gotsi, E. (2007). A comparative study on the airbone fungi in Athens, Greece, by viable and non-viable sampling methods. Aerobiologia 23, 3-15.
- 1469. Ponikau, J. U., Sherris, D. A., Kephart, G. M., Adolphson, C., and Kita, H. (2006). The role of ubiquitous airborne fungi in chronic rhinosinusitis. Clin Rev Allergy Immunol. 30[3], 187-194.
- 1481. Schwarze, P. E., Ovrevik, J., Lag, M., Refsnes, M., Nafstad, P., Hetland, R. B., and Dybing, E. (2006). Particulate matter properties and health effects: consistency of epidemiological and toxicological studies. Hum Exp Toxicol. 25[10], 559-579.
- 1570. Pulimood, T. B., Corden, J. M., Bryden, C., Sharples, L., and Nasser, S. M. (2007). Epidemic asthma and the role of the fungal mold Alternaria alternata. J Allergy Clin Immunol. 120[3], 610-617.
- 1584. Basilico, Mde L., Chiericatti, C., Aringoli, E. E., Althaus, R. L., and Basilico, J. C. (2007). Influence of environmental factors on airborne fungi in houses of Santa Fe City, Argentina. Sci Total Environ. 376[1-3], 143-150.
- 1585. Niedoszytko, M., Chelminska, M., Jassem, E., and Czestochowska, E. (2007). Association between sensitization to Aureobasidium pullulans (Pullularia sp) and severity of asthma. Ann Allergy Asthma Immunol. 98[2], 153-156.
- 1598. Xie, L., Zhai, H., Shi, W., Zhao, J., Sun, S., and Zang, X. (2007). Hyphal Growth Patterns and Recurrence of Fungal Keratitis after Lamellar Keratoplasty. Ophthalmology. .
- 1635. De Lucca, A. J. (2007). Harmful fungi in both agriculture and medicine. Rev Iberoam.Micol. 24[1], 3-13.
- 1675. Greenberger, P. A. (2004). Mold-induced hypersensitivity pneumonitis. Allergy Asthma Proc. 25[4], 219-223.
- 1747. Tomsikova, A. (2002). Causative agents of nosocomial mycoses. Folia Microbiol (Praha). 47[2], 105-112.
- 1756. Bokhary, H. A. and Parvez, S. (1995). Fungi inhabiting household environments in Riyadh, Saudi Arabia. Mycopathologia. 130[2], 79-87.
- 1771. Gupta, J., Pathak, B., Sethi, N., and Vora, V. C. (1981). Histopathology of Mycotoxicosis produced in Swiss albino mice by metabolites of some fungal isolates. Appl Environ Microbiol. 41[3], 752-757.
- 1777. Chattopadhyay, B. P., Das, S., Adhikari, A., and Alam, J. (2007). Exposure to varying concentration of fungal spores in grain storage godowns and its effect on the respiratory function status among the workers. Ind Health. 45[3], 449-461.
- 1778. Labuda, R. and Tancinova, D. (2006). Fungi recovered from Slovakian poultry feed mixtures and their toxinogenity. Ann Agric Environ Med. 13[2], 193-200.
- 1780. Atkinson, R. W., Strachan, D. P., Anderson, H. R., Hajat, S., and Emberlin, J. (2006). Temporal associations between daily counts of fungal spores and asthma exacerbations. Occup Environ Med. 63[9], 580-590.
- 1788. Gioulekas, D., Damialis, A., Papakosta, D., Spieksma, F., Giouleka, P., and Patakas, D. (2004). Allergenic fungi spore records (15 years) and sensitization in patients with respiratory allergy in Thessaloniki-Greece. J Investig.Allergol.Clin Immunol. 14[3], 225-231.
- 1790. Abdel Hameed, A. A., Yasser, I. H., and Khoder, I. M. (2004). Indoor air quality during renovation actions: a case study. J Environ Monit. 6[9], 740-744.
- 1792. Safdar, A., Singhal, S., and Mehta, J. (2004). Clinical significance of non-Candida fungal blood isolation in patients undergoing high-risk allogeneic hematopoietic stem cell transplantation (1993-2001). Cancer. 100[11], 2456-2461.
- 1814. Su, H. J., Rotnitzky, A., Burge, H. A., and Spengler, J. D. (1992). Examination of fungi in domestic interiors by using factor analysis: correlations and associations with home factors. Appl Environ Microbiol. 58[1], 181-186.
- 1819. Pritchard, R. C. and Muir, D. B. (1987). Black fungi: a survey of dematiaceous hyphomycetes from clinical specimens identified over a five year period in a reference laboratory. Pathology. 19[3], 281-284.
- 1821. Rogers, S. A. (1984). A 13-month work-leisure-sleep environment fungal survey. Ann Allergy. 52[5], 338-341.
- 1822. Burge, H. A., Solomon, W. R., and Muilenberg, M. L. (1982). Evaluation of indoor plantings as allergen exposure sources. J Allergy Clin Immunol. 70[2], 101-108.
- 1838. Chasseur, C., Suetens, C., Michel, V., Mathieu, F., Begaux, F., Nolard, N., and Haubruge, E. (2001). A 4-year study of the mycological aspects of Kashin-Beck disease in Tibet. Int Orthop. 25[3], 154-158.
- 1840. Pieckova, E. and Jesenska, Z. (1998). Molds on house walls and the effect of their chloroform-extractable metabolites on the respiratory cilia movement of one-day-old chicks in vitro. Folia Microbiol (Praha). 43[6], 672-678.
- 1841. Kwaasi, A. A., Parhar, R. S., al-Mohanna, F. A., Harfi, H. A., Collison, K. S., and al-Sedairy, S. T. (1998). Aeroallergens and viable microbes in sandstorm dust. Potential triggers of allergic and nonallergic respiratory ailments. Allergy. 53[3], 255-265.
- 2001. Orman, A., Ficici, S. E., Ay, A., Ellidokuz, H., Sivaci, R. G., and Konuk, M. (2005). Detection of fungi spectrum in industrial and home bakeries and determinated fungal allergy with skin prick test. Asian Pac J Allergy Immunol. 23[2-3], 79-85.
- 2031. Sorensen, J., Becker, M., Porto, L., Lambrecht, E., Schuster, T., Beske, F., Rickerts, V., Klingebiel, T., and Lehrnbecher, T. (2006). Rhinocerebral zygomycosis in a young girl undergoing allogeneic stem cell transplantation for severe aplastic anaemia. Mycoses. 49 Suppl 1:31-6., 31-36.
- 2193. Ismail, M. A. and Abdel-Sater, M. A. (1994). Mycoflora inhabiting water closet environments. Mycoses. 37[1-2], 53-57.
- 2216. Temprano, J., Becker, B. A., Hutcheson, P. S., Knutsen, A. P., Dixit, A., and Slavin, R. G. (2007). Hypersensitivity pneumonitis secondary to residential exposure to Aureobasidium pullulans in 2 siblings. Ann Allergy Asthma Immunol. 99[6], 562-566.
- 2226. Lugauskas, A., Sveistyte, L., and Ulevicius, V. (2003). Concentration and species diversity of airborne fungi near busy streets in Lithuanian urban areas. Ann Agric Environ Med. 10[2], 233-239.
- 2285. Horner, W. E., Helbling, A., Salvaggio, J. E., and Lehrer, S. B. (1995). Fungal allergens. Clin Microbiol Rev 8[2], 161-179.
- 2288. Simmons, R. B., Noble, J. A., Rose, L., Price, D. L., Crow, S. A., and Ahearn, D. G. (1997). Fungal colonization of automobile air conditionning systems. Journal of Industrial Microbiology & Biotechnology 19, 150-153.
- 2331. van, Halderen A., Green, J. R., Marasas, W. F., Thiel, P. G., and Stockenstrom, S. (1989). A field outbreak of chronic aflatoxicosis in dairy calves in the western Cape Province. J S Afr.Vet.Assoc. 60[4], 210-211.
- 2355. Levetin, E. and Horner, W. E. (2002). Fungal aerobiology: exposure and measurement. Chem Immunol. 81:10-27., 10-27.
- 2373. Adhikari, A., Sen, M. M., Gupta-Bhattacharya, S., and Chanda, S. (2004). Volumetric assessment of airborne fungi in two sections of a rural indoor dairy cattle shed. Environ Int. 29[8], 1071-1078.
- 2388. Jo, W. K. and Seo, Y. J. (2005). Indoor and outdoor bioaerosol levels at recreation facilities, elementary schools, and homes. Chemosphere. 61[11], 1570-1579.
- 2396. Szymanska, J. (2006). Exposure to airborne fungi during conservative dental treatment. Ann Agric Environ Med. 13[1], 177-179.
- 2401. Adhikari, A., Sen, M. M., Gupta-Bhattacharya, S., and Chanda, S. (2000). Incidence of allergenically significant fungal aerosol in a rural bakery of West Bengal, India. Mycopathologia. 149[1], 35-45.
- 2517. Takahashi, T. (1997). Airborne fungal colony-forming units in outdoor and indoor environments in Yokohama, Japan. Mycopathologia. 139[1], 23-33.
- 2544. Farruggia, E. and Bellia, M. (2001). [Occupational allergic asthma in greenhouses. Report of a clinical case]. Med Lav. 92[3], 203-205.
- 2546. Flournoy, D. J., Mullins, J. B., and McNeal, R. J. (2000). Isolation of fungi from rose bush thorns. J Okla.State Med Assoc. 93[7], 271-274.
- 2558. Karpovich-Tate, N., Dewey, F. M., Smith, E. J., Lund, V. J., Gurr, P. A., and Gurr, S. J. (2000). Detection of fungi in sinus fluid of patients with allergic fungal rhinosinusitis. Acta Otolaryngol. 120[2], 296-302.
- 2640. Arbes, S. J., Sever, M., Mehta, J., Collette, N., Thomas, B., and Zeldin, D. C. (2005). Exposure to indoor allergens in day-care facilities: results from 2 North Carolina counties. J Allergy Clin Immunol. 116[1], 133-139.
- 2641. Arbes, S. J., Jr., Gergen, P. J., Vaughn, B., and Zeldin, D. C. (2007). Asthma cases attributable to atopy: results from the Third National Health and Nutrition Examination Survey. J Allergy Clin Immunol. 120[5], 1139-1145.
- 2642. Asturias, J. A., Ibarrola, I., Ferrer, A., Andreu, C., Lopez-Pascual, E., Quiralte, J., Florido, F., and Martinez, A. (2005). Diagnosis of Alternaria alternata sensitization with natural and recombinant Alt a 1 allergens. J Allergy Clin Immunol. 115[6], 1210-1217.
- 2643. Barnes, S. D., Dohlman, C. H., and Durand, M. L. (2007). Fungal colonization and infection in Boston keratoprosthesis. Cornea. 26[1], 9-15.
- 2644. Bavbek, S., Erkekol, F. O., Ceter, T., Mungan, D., Ozer, F., Pinar, M., and Misirligil, Z. (2006). Sensitization to Alternaria and Cladosporium in patients with respiratory allergy and outdoor counts of mold spores in Ankara atmosphere, Turkey. J Asthma. 43[6], 421-426.
- 2645. Bonatti, H., Lass-Florl, C., Zelger, B., Lottersberger, C., Singh, N., Pruett, T. L., Margreiter, R., and Schneeberger, S. (2007). Alternaria alternata soft tissue infection in a forearm transplant recipient. Surg Infect (Larchmt.). 8[5], 539-544.
- 2647. Cardoso, S. V., Campolina, S. S., Guimaraes, A. L., Faria, P. R., da, C. Costa EM, Gomez, R. S., Rocha, A., Caligiorne, R. B., and Loyola, A. M. (2007). Oral phaeohyphomycosis. J Clin Pathol. 60[2], 204-205.
- 2649. Cooley, J. D., Wong, W. C., Jumper, C. A., and Straus, D. C. (1998). Correlation between the prevalence of certain fungi and sick building syndrome. Occup Environ Med. 55[9], 579-584.
- 2650. Douglas, R., Bruhn, M., Tan, L. W., Ooi, E., Psaltis, A., and Wormald, P. J. (2007). Response of peripheral blood lymphocytes to fungal extracts and staphylococcal superantigen B in chronic rhinosinusitis. Laryngoscope. 117[3], 411-414.
- 2658. Krysinska-Traczyk, E., Skorska, C., Prazmo, Z., Sitkowska, J., Cholewa, G., and Dutkiewicz, J. (2004). Exposure to airborne microorganisms, dust and endotoxin during flax scutching on farms. Ann Agric Environ Med. 11[2], 309-317.
- 2666. Menzies, D., Comtois, P., Pasztor, J., Nunes, F., and Hanley, J. A. (1998). Aeroallergens and work-related respiratory symptoms among office workers. J Allergy Clin Immunol. 101[1 Pt 1], 38-44.
- 2671. Podda, L., Fozza, C., Nieddu, R., Sanna, S., Paglietti, B., Vacca, A., La, Nasa G., and Longinotti, M. (2008). Breakthrough cutaneous alternariosis in a patient with acute lymphoblastic leukemia: clinical features and diagnostic issues. Leuk.Lymphoma. 49[1], 154-155.
- 2672. Rivoire, B., Attucci, S., Anthonioz, P., Carre, P., Lemarie, E., and Hazouard, E. (2001). Occupational acute lung injury due to Alternaria alternata: early stage of organic dust toxic syndrome requires no corticosteroids. Intensive Care Med. 27[7], 1236-1237.
- 2674. Romano, C., Vanzi, L., Massi, D., and Difonzo, E. M. (2005). Subcutaneous alternariosis. Mycoses. 48[6], 408-412.
- 2676. Schneider, P. B., Denk, U., Breitenbach, M., Richter, K., Schmid-Grendelmeier, P., Nobbe, S., Himly, M., Mari, A., Ebner, C., and Simon-Nobbe, B. (2006). Alternaria alternata NADP-dependent mannitol dehydrogenase is an important fungal allergen. Clin Exp Allergy. 36[12], 1513-1524.
- 2678. Shin, S. H., Ye, M. K., and Lee, Y. H. (2007). Fungus culture of the nasal secretion of chronic rhinosinusitis patients: seasonal variations in Daegu, Korea. Am J Rhinol. 21[5], 556-559.
- 2680. Skorska, C., Sitkowska, J., Krysinska-Traczyk, E., Cholewa, G., and Dutkiewicz, J. (2005). Exposure to airborne microorganisms, dust and endotoxin during processing of peppermint and chamomile herbs on farms. Ann Agric Environ Med. 12[2], 281-288.
- 2681. Sood, N., Gugnani, H. C., Guarro, J., Paliwal-Joshi, A., and Vijayan, V. K. (2007). Subcutaneous phaeohyphomycosis caused by Alternaria alternata in an immunocompetent patient. Int J Dermatol. 46[4], 412-413.
- 2683. Veer, P., Patwardhan, N. S., and Damle, A. S. (2007). Study of onychomycosis: prevailing fungi and pattern of infection. Indian J Med Microbiol. 25[1], 53-56.
- 2684. Verma, K., Vajpayee, R. B., Titiyal, J. S., Sharma, N., and Nayak, N. (2005). Post-LASIK infectious crystalline keratopathy caused by Alternaria. Cornea. 24[8], 1018-1020.
- 2685. Vieira, R., Veloso, J., Afonso, A., and Rodrigues, A. (2006). Cutaneous alternariosis in a liver transplant recipient. Rev Iberoam.Micol. 23[2], 107-109.
- 2749. Frisvad, J. C., Filtenborg, O., and Thrane, U. (1989). Analysis and screening for mycotoxins and other secondary metabolites in fungal cultures by thin-layer chromatography and high-performance liquid chromatography. Arch Environ Contam Toxicol. 18[3], 331-335.
- 2865. Anandan, V., Nayak, V., Sundaram, S., and Srikanth, P. (2008). An association of Alternaria alternata and Scopulariopsis brevicaulis in cutaneous phaeohyphomycosis. Indian J Dermatol.Venereol.Leprol. 74[3], 244-247.
- 2919. doPico, G. A., Reddan, W. G., Chmelik, F., Peters, M. E., Reed, C. E., and Rankin, J. (1976). The value of precipitating antibodies in screening for hypersensitivity pneumonitis. Am Rev Respir Dis. 113[4], 451-455.
- 2989. Palmas, F., Cosentino, S., and Cardia, P. (1989). Fungal air-borne spores as health risk factors among workers in alimentary industries. Eur J Epidemiol. 5[2], 239-243.
- 3010. Baur, X., Behr, J., Dewair, M., Ehret, W., Fruhmann, G., Vogelmeier, C., Weiss, W., and Zinkernagel, V. (1988). Humidifier lung and humidifier fever. Lung. 166[2], 113-124.
- 3207. Mari, A., Schneider, P., Wally, V., Breitenbach, M., and Simon-Nobbe, B. (2003). Sensitization to fungi: epidemiology, comparative skin tests, and IgE reactivity of fungal extracts. Clin.Exp.Allergy. 33[10], 1429-1438.
- 3284. Hollister-Stier Laboratories. (2009). Allergenic extracts : Molds. Hollister-Stier Laboratories .
- 3285. Federal Drug Administration (FDA). (2008). Biological products deviation reporting (BPDR). Non-blood product codes. 3-29-2009.
- 3318. UniProt Consortium. (2009). Taxonomy : fungi metazoa group. Site de UniProt . 4-6-2009.
- 3483. Pohland, A. E. (1993). Mycotoxins in review. Food.Addit.Contam. 10[1], 17-28.
- 3593. Ogawa, H., Fujimura, M., Tofuku, Y., and Kitagawa, M. (2009). Eosinophilic pneumonia caused by Aspergillus niger: is oral cleansing with amphotericin B efficacious in preventing relapse of allergic pneumonitis? J Asthma. 46[1], 95-98.
- 3671. Brandt, M. E. and Warnock, D. W. (2003). Epidemiology, clinical manifestations, and therapy of infections caused by dematiaceous fungi. J Chemother. 15 Suppl 2:36-47., 36-47.
- 3717. Van, Lancker F., Adams, A., Delmulle, B., De, Saeger S., Moretti, A., Van, Peteghem C., and De, Kimpe N. (2008). Use of headspace SPME-GC-MS for the analysis of the volatiles produced by indoor molds grown on different substrates. J Environ.Monit. 10[10], 1127-1133.
- 3729. Flannigan, B., Samson, R. A., and Miller, J. D. (2002). Microorganisms in home and indoor work environments: diversity, health impacts, investigation and control. -504 p. CRC Press.
- 3748. Lawley, R. (2009). Alternaria toxins. Site de Micotoxinas online . 7-21-2009.
- 3760. Schmechel, D., Green, B. J., Blachere, F. M., Janotka, E., and Beezhold, D. H. (2008). Analytical bias of cross-reactive polyclonal antibodies for environmental immunoassays of Alternaria alternata. J Allergy.Clin.Immunol. 121[3], 763-768.
- 3799. Goetz, D. W., Webb, E. L., Jr., Whisman, B. A., and Freeman, T. M. (1997). Aeroallergen-specific IgE changes in individuals with rapid human immunodeficiency virus disease progression. Ann.Allergy.Asthma.Immunol. 78[3], 301-306.
- 3800. Panda, A., Sharma, N., Das, G., Kumar, N., and Satpathy, G. (1997). Mycotic keratitis in children: epidemiologic and microbiologic evaluation. Cornea. 16[3], 295-299.
- 3802. Chang, C. Z., Hwang, S. L., and Howng, S. L. (1997). Allergical fungal sinusitis with intracranial abscess--a case report and literature review. Kaohsiung.J Med Sci. 13[11], 685-689.
- 3805. Vennewald, I., Henker, M., Klemm, E., and Seebacher, C. (1999). Fungal colonization of the paranasal sinuses. Mycoses. 42 Suppl 2:33-6., 33-36.
- 3807. Gilmour, T. K., Rytina, E., O'Connell, P. B., and Sterling, J. C. (2001). Cutaneous alternariosis in a cardiac transplant recipient. Australas.J Dermatol. 42[1], 46-49.
- 3808. Jahagirdar, B. N. and Morrison, V. A. (2002). Emerging fungal pathogens in patients with hematologic malignancies and marrow/stem-cell transplant recipients. Semin.Respir.Infect. 17[2], 113-120.
- 3809. Wheat, L. J., Goldman, M., and Sarosi, G. (2002). State-of-the-art review of pulmonary fungal infections. Semin.Respir.Infect. 17[2], 158-181.
- 3811. Zahra, L. V., Mallia, D., Hardie, J. G., Bezzina, A., and Fenech, T. (2002). Case Report. Keratomycosis due to Alternaria alternata in a diabetic patient. Mycoses. 45[11-12], 512-514.
- 3817. Kazory, A., Ducloux, D., Reboux, G., Blanc, D., Faivre, B., Chalopin, J. M., and Piarroux, R. (2004). Cutaneous Alternaria infection in renal transplant recipients: a report of two cases with an unusual mode of transmission. Transpl.Infect.Dis. 6[1], 46-49.
- 3818. Gilaberte, M., Bartralot, R., Torres, J. M., Reus, F. S., Rodriguez, V., Alomar, A., and Pujol, R. M. (2005). Cutaneous alternariosis in transplant recipients: clinicopathologic review of 9 cases. J Am.Acad.Dermatol. 52[4], 653-659.
- 3821. Torres-Rodriguez, J. M., Gonzalez, M. P., Corominas, J. M., and Pujol, R. M. (2005). Successful thermotherapy for a subcutaneous infection due to Alternaria alternata in a renal transplant recipient. Arch.Dermatol. 141[9], 1171-1173.
- 3832. Williams, C., Layton, A. M., Kerr, K., Kibbler, C., and Barton, R. C. (2008). Cutaneous infection with an Alternaria sp. in an immunocompetent host. Clin.Exp.Dermatol. 33[4], 440-442.
- 3842. Kendrick, B. and Murase, G. (2003). Anamorph-teleomorph dabase. CBS. Centraalbureau voor Schimmelcultures. 2009.
- 3847. Haubruge, E., Chasseur, C., Debouck, C., Begaux, F., Suetens, C., Mathieu, F., Michel, V., Gaspar, C., Rooze, M., Hinsenkamp, M., Gillet, P., Nolard, N., and Lognay, G. (2001). The prevalence of mycotoxins in Kashin-Beck disease. Int.Orthop. 25[3], 159-161.
- 3858. Frisvad, J. C., Andersen, B., and Thrane, U. (2008). The use of secondary metabolite profiling in chemotaxonomy of filamentous fungi. Mycol.Res. 112[Pt 2], 231-240.
- 3873. Weidenb÷rner, M. (2001). Encyclopedia of food mycotoxins.
- 3877. Hedayati, M. T., Arabzadehmoghadam, A., and Hajheydari, Z. (2009). Specific IgE against Alternaria alternata in atopic dermatitis and asthma patients. Eur.Rev.Med Pharmacol.Sci. 13[3], 187-191.
- 3878. Nasser, S. M. and Pulimood, T. B. (2009). Allergens and thunderstorm asthma. Curr.Allergy.Asthma.Rep. 9[5], 384-390.
- 3896. Bush, R. K. and Prochnau, J. J. (2004). Alternaria-induced asthma. J Allergy.Clin.Immunol. 113[2], 227-234.
- 3902. Halonen, M., Stern, D. A., Wright, A. L., Taussig, L. M., and Martinez, F. D. (1997). Alternaria as a major allergen for asthma in children raised in a desert environment. Am.J Respir.Crit.Care Med. 155[4], 1356-1361.
- 3904. Neukirch, C., Henry, C., Leynaert, B., Liard, R., Bousquet, J., and Neukirch, F. (1999). Is sensitization to Alternaria alternata a risk factor for severe asthma? A population-based study. J Allergy.Clin.Immunol. 103[4], 709-711.
- 3905. Patel, H. J., Douglas, G. J., Herd, C. M., Spina, D., Giembycz, M. A., Barnes, P. J., Belvisi, M. G., and Page, C. P. (1999). Antigen-induced bronchial hyperresponsiveness in the rabbit is not dependent on M(2)-receptor dysfunction. Pulm.Pharmacol.Ther. 12[4], 245-255.
- 3907. Peat, J. K., Tovey, E., Mellis, C. M., Leeder, S. R., and Woolcock, A. J. (1993). Importance of house dust mite and Alternaria allergens in childhood asthma: an epidemiological study in two climatic regions of Australia. Clin.Exp.Allergy. 23[10], 812-820.
- 3910. Zureik, M., Neukirch, C., Leynaert, B., Liard, R., Bousquet, J., and Neukirch, F. (2002). Sensitisation to airborne moulds and severity of asthma: cross sectional study from European Community respiratory health survey. BMJ. 325[7361], 411-414.
- 3911. Simon-Nobbe, B., Probst, G., Kajava, A. V., Oberkofler, H., Susani, M., Crameri, R., Ferreira, F., Ebner, C., and Breitenbach, M. (2000). IgE-binding epitopes of enolases, a class of highly conserved fungal allergens. J Allergy.Clin.Immunol. 106[5], 887-895.
- 3912. Simon-Nobbe, B., Denk, U., Poll, V., Rid, R., and Breitenbach, M. (2008). The spectrum of fungal allergy. Int.Arch.Allergy.Immunol. 145[1], 58-86.
- 3929. Brugger, E. M., Wagner, J., Schumacher, D. M., Koch, K., Podlech, J., Metzler, M., and Lehmann, L. (2006). Mutagenicity of the mycotoxin alternariol in cultured mammalian cells. Toxicol.Lett. 164[3], 221-230.
- 3930. Morrison, V. A. and Weisdorf, D. J. (1993). Alternaria: a sinonasal pathogen of immunocompromised hosts. Clin.Infect.Dis. 16[2], 265-270.
- 3931. Morrison, V. A., Haake, R. J., and Weisdorf, D. J. (1993). The spectrum of non-Candida fungal infections following bone marrow transplantation. Medicine (Baltimore.). 72[2], 78-89.
- 3932. Schell, W. A. (2000). Unusual fungal pathogens in fungal rhinosinusitis. Otolaryngol.Clin.North.Am. 33[2], 367-373.
- 3933. Wadhwani, K. and Srivastava, A. K. (1984). Fungi from otitis media of agricultural field workers. Mycopathologia. 88[2-3], 155-159.
- 3938. Kaplan, R. L. (1982). Hypersensitivity pneumonitis due to Alternaria tenuis. Pa.Med. 85[1], 34.
- 3940. Fink, J. N., Schlueter, D. P., and Barboriak, J. J. (1973). Hypersensitivity pneumonitis due to exposure to Alternaria. Chest. 63:Suppl:49S., Suppl.
- 3942. Weiss, W. and Baur, X. (1987). [Solid phase radioimmunoassay for the quantitative determination of antigen-specific IgG-antibodies in the serum of patients with farmer's lung]. J Clin.Chem.Clin.Biochem. 25[10], 689-698.







