Phoma glomerata
Introduction
Phoma est le genre le plus largement distribué de l’ordre des Pleosporales (ou Sphaeropsidales lorsqu’il est considéré en tant que Fungi Imperfecti) et le plus important avec environ 2 000 espèces {1878, 1056}. La taxonomie de ce genre est compliquée et l’identification des espèces est souvent difficile : la définition du genre n’est pas entièrement comprise {479}. Les critères usuels servant à identifier le genre sont bien établis; toutefois, les éléments servant à définir les espèces et les sous-espèces demeurent parfois à préciser. Plusieurs des souches isolées dans les cas d’infections humaines n’ont pas été identifiées au niveau de l’espèce {816, 3841}. Trois espèces de Phoma (P. exigua, P. foveata, P. sambuci-nigrae) et quatre cultivars de Phoma exigua sont enregistrés; de plus, quelques souches sont enregistrées mais non nommées {3318}.
Plusieurs espèces de Phoma s’adaptent facilement aux paramètres de l’environnement intérieur et se développent bien sur des matériaux de construction. Le Phoma glomerata est l’espèce la plus commune en milieu intérieur. Le texte des pages qui suivent concernera surtout cette espèce, mais il ne faut pas oublier que la plupart des souches isolées des échantillons d’air ou associées à des cas d’infections humaines sont identifiées seulement au genre et ne pourront donc être appelées ici qu’« espèces de Phoma » ou « Phoma sp. ».
Taxonomie
| Règne | Fungi | Famille | Pleosporaceae |
| Phylum | Ascomycota (Deuteromycota) | Genre | Phoma |
| Classe | Euascomycetes | Espèce | glomerata |
| Ordre | Pleosporales (Sphaeropsidales) |
Les Phoma spp. sont des hyphomycètes anamorphes dématiacés : on connaît plusieurs espèces de Phoma qui ont des formes sexuées ou télémorphes incluses dans 30 genres {3842}, les plus connus étant Pleospora {816}, Didmyella etLeptosphaeria {3842}.
Écologie
Phoma est un mycète omniprésent et répandu; des espèces ont été trouvées dans le sol et sur diverses matières végétales mortes ou vivantes {813, 3729, 816, 3855, 1056}; il est un des agents phytopathogènes les plus importants {1931, 1696}. Selon une clef d’identification spécialisée, 223 taxa seraient répandus en Europe de l’Ouest et seraient même connus en Australie, en Amérique du Nord de même qu’en Eurasie {3861}.
Le Phoma se trouve également sur les produits du bois (bouleau), le papier, les textiles (laine), le cuir, certains aliments contenant des gras végétal et animal, les produits laitiers de même que sur les fruits et les légumes {989, 3729, 1056}. Les espèces de Phoma semblent avoir une affinité pour les substrats contenant des lipides, telles les graines et les noix {3965, 3967, 3966, 3968}.
La prévalence des spores de Phoma dans l’air extérieur tend à être faible ou très faible, même si le Phoma est un des mycètes les plus communs et les plus abondants à la surface des feuilles {1281, 3853}; cette contradiction apparente peut provenir du fait que des spores contenues dans les fructifications ne sont pas facilement dispersées et que la propagation réelle de ce genre pourrait surtout être accomplie par les ascospores des formes télémorphes. Par exemple, une étude menée à Tulsa (Oklahoma) a évalué à 100 % la prévalence de Phoma dans l’environnement et a relevé des concentrations de ce mycète aussi élevées que 3,7 ufc/cm à la surface des feuilles des arbres, mais ces mesures ne représentaient que 12,3 % des décomptes totaux; le Phoma était suivi de près par le Cladosporium {1281}. De même, aux Pays-Bas, le Phoma était l’un des mycètes aéroportés les moins abondants, avec une concentration de 1 ufc/m³ {864}. En Grèce, dans la ville de Thessaloniki, de 1987 à 2001, Phoma a semblé être le mycète avec la plus faible prévalence dans l’air extérieur (0,06 %) {1788}. En Arabie Saoudite, Abdel-Hafez et Shoreit {930} ont récupéré Phoma dans 60 % des échantillons d’air (croissance sur milieu de Czapek); ce genre constituait 9,5 % des mycètes totaux, et trois espèces ont été identifiées : P. glomerata, P. humicola et P. herbarum.
Exigences de croissance
La température de croissance optimale des espèces de Phoma est de 26 à 37 °C, mais certaines espèces comme le P. glomerata sont incapables de pousser à 37 °C {989}. Ces mycètes sont hydrophiles et poussent bien sur des matériaux humides à des taux approchant le point de saturation {3729}.
Activité de l’eau : Aw ³ 0,90 {3729}.
Croissance sur matériaux de construction et en environnement intérieur
Dans l’environnement intérieur, le Phoma sp. est commun sur les surfaces peintes, mouillées ou humides; le bois; les papiers peints; les cadres de fenêtres; les tuiles de plafond, les tapis et l’envers des linoléums, et il est souvent isolé dans la poussière domestique {3972, 3729, 1696, 1193, 1056}. Le Phoma sp. peut produire des taches roses et pourpres sur les murs peints en raison de la présence de pigments diffusibles {818}. Il peut également se développer sur du ciment, du caoutchouc et du papier. Le Phoma glomerata a pour sa part été rencontré sur du bois, du ciment, des surfaces peintes avec de la peinture à l’huile et sur du papier {3729, 1056}.
Cependant, une étude expérimentale réalisée en laboratoire a démontré que sa croissance sur des panneaux de gypse humides était lente, et les signes de croissance ne sont pas apparus avant la septième semaine {587}. On signale également que le Phoma sp., croissant sur des matériaux de construction, pourrait avoir peu d’effets sur la qualité de l’air intérieur, puisque les spores contenues à l’intérieur des fructifications ne sont pas aisément disséminées {813}. De plus, les résultats des études ayant trait à la prévalence de ce mycète, en suspension dans l’air, en milieu intérieur varient grandement.
Plus de détails
Dans 68 maisons situées dans le sud de la Californie, la fréquence d’isolement de Phoma était très faible, soit de 1,5 % {1824}. Lors d’une étude réalisée dans l’État de New York, des pétris ont été exposés pendant 13 mois dans des environnements à vocation mixte (travail – loisirs – dortoir) de 130 patients ; parmi les 20 espèces détectées, Phoma était la quatorzième en importance, avec une prévalence de 14 % {1821}.
Une étude a été réalisée dans un bain public contenant des douches et des vestiaires qui avaient connu des problèmes d’infiltration d’eau par le toit et des problèmes de condensation. Les cultures des échantillons prélevés sur des surfaces ont démontré une croissance importante de Phoma sp. en présence de deux autres espèces dominantes, soit le Trichoderma et le Fusarium {449}. Dans un autre environnement humide, un rideau de douche était fortement souillé par une masse gris brunâtre de spores fongiques et de mycélium : la culture de cette masse a révélé la présence de trois espèces, et le Phoma violacea était l’une de ces espèces {1899}. L’étude sérologique subséquente de 24 patients présentant des symptômes non expliqués de pneumonite d’hypersensibilité (HP) a été menée avec des extraits allergènes provenant des mycètes isolés à partir du rideau de douche; les sérums de 4 patients présentaient des épreuves sérologiques positives pour les IgG anti-Phoma et négatives pour tous les autres tests.
Laboratoire
La manipulation des cultures de ce genre doit se faire en respectant les précautions de laboratoire de base (niveau de biosécurité 2).
Morphologie macroscopique des colonies
Les colonies de Phoma se développent bien sur les milieux de culture mycologique habituels {813, 415}. Elles viennent à maturité habituellement en dedans de 5 jours et ont tendance à s’étendre {412}; les colonies atteignent une taille d’environ 10 cm après 8 à 10 jours en culture sur gélose à l’extrait de malt (MEA) {989}; les colonies sont brun grisâtre et poudreuses, veloutées ou cotonneuses. Le revers de la colonie est brun foncé à olive au centre et plus pâle à la périphérie {989}; quelques espèces produisent un pigment diffusible, allant du pourpre rougeâtre au brun jaunâtre {412}, qui est facilement visible au revers de la colonie {816}.
Morphologie microscopique
Des hyphes septés (70-100 µm de diamètre), hyalins ou bruns, portent des fructifications asexuées, nommées pycnidies. Ces pycnidies sont rondes ou piriformes et de 200 x 50-200 µm de diamètre, et elles contiennent des conidies qui s’échappent à maturité par une ouverture appelée ostiole. Les conidies, formées sur des conidiophores à l’intérieur de la pycnidie, sont ovales, unicellulaires et hyalines {989, 412, 479, 1056, 415}. Les pycnidies ostiolées aseptées sont une caractéristique qui distingue les Phoma des autres moisissures semblables {1931}. Phoma est parfois confondu avec Pyrenochaeta, mais les deux peuvent être différenciés sur la base de la structure des cellules conidiogènes {479}.
Le Phoma glomerata peut, pour sa part, être distingué d’autres espèces communes de Phoma en milieu intérieur par la présence de chlamydospores foncées multicellulaires avec des septums verticaux alternes (ressemblant un peu à des spores d’Alternaria), et parfois de chlamydospores unicellulaires; les spores multicellulaires en chaînes sont également connues en tant que dictyochlamydospores catenates.
Métabolites spécifiques
Composés organiques (incluant les COV)
Il n’y a aucun composé organique volatil (COV), décrit comme étant spécifiquement produit par les espèces de Phoma, qui serait nocif pour les humains ou les animaux.
Mycotoxines
Les espèces de Phoma sont connues pour leur production de toxines dirigées contre des cellules végétales ou animales.
Parmi ces dernières, certaines substances ont été reconnues comme étant cytotoxiques lorsqu’elles sont étudiées avec un modèle animal; parmi ces substances il faut noter les cytochalasines A et B (la cytochalasine B est également appelée phomine), la déoxaphomine, la proxiphomine et l’acide tenuazonique {3866, 1883, 3973, 3867}. Selon un auteur, le Phoma glomerata produit de l’acide kojique et de l’aflatoxine {989}. Des toxines de Phoma ont été isolées dans les céréales, les graines et les noix contaminées. Aucune donnée n’a été publiée concernant des toxines de Phoma produites sur des matériaux de construction.
Plus de détails
Les toxines de Phoma exigua suivantes ont été isolées à partir de produits de l’orge : les cytochalasines A et B, la déoxaphomine et la proxiphomine {1883}. Bien que cela soit rare, des espèces de Phoma ont été isolées à partir du coprah, des arachides et des pacanes {3965, 3967, 3966, 3968}. Ces substrats riches en lipides pourraient être de bons substrats pour les Phoma et pour la production de leurs mycotoxines; il faut noter que de l’acide tenuazonique a ainsi déjà été détecté dans de la farine de graines de tournesol {3147}.
Problèmes de santé
Les risques sanitaires associés à l’exposition aux moisissures dans les bâtiments endommagés par l’eau sont bien établis, particulièrement pour ce qui est des symptômes reliés aux voies respiratoires supérieures et inférieures. Phoma croît souvent sur des matériaux de construction, mais il est un des mycètes aéroportés les moins répandus dans l’air intérieur, car les spores contenues dans les pycnidies ne sont pas facilement aérosolisées. Par conséquent, sa contribution aux effets néfastes d’une mauvaise qualité de l’air intérieur sur la santé est probablement limitée.
Irritation et inflammation
Aucune donnée n’a été publiée à propos de substances spécifiques produites par des espèces de Phoma, qui auraient un effet irritatif ou inflammatoire.
Plus de détails
D’une manière générale, toutes les moisissures contiennent des substances qui sont des irritants et qui favorisent l’inflammation à un certain degré. Des études rapportent que certains composés organiques volatils (COV) produits par des moisissures en milieu intérieur sur des matériaux de construction humides contribueraient à différents problèmes de santé, telle l’irritation des yeux, du nez et la gorge, et contribueraient peut-être même à des problèmes comme la léthargie et les maux de tête {594}.
Réactions allergiques
Phoma est considéré comme un allergène commun dans l’air extérieur et dans l’air intérieur. Phoma sp. est rapporté comme étant un mycète associé à des réactions allergiques de Type I (rhinite) et comme pouvant causer une pneumonite d’hypersensibilité de Type III (HP) {3870, 989}.
La sensibilisation allergique à Phoma est beaucoup plus répandue chez les sujets dits « atopiques » que sa concentration en air extérieur ne l’aurait laissé prévoir. Une étude canadienne a été menée auprès de personnes souffrant de rhinite ou d’asthme allergique et dont les épreuves cutanées étaient positives pour les espèces fongiques aéroportées : les résultats ont montré que 36 % des sujets réagissaient au Phoma glomerata, et ce, malgré le fait que cette espèce ait été isolée dans moins de 1 % des échantillons d’air extérieur et intérieur {1817}. En Angleterre, Buisseret a observé des résultats semblables chez des patients présentant de l’asthme saisonnier ou de l’asthme dit « d’été » : 10 % étaient allergiques aux spores fongiques, particulièrement à Alternaria et au Phoma {3871}. De même, au cours d’une étude concernant les anticorps de type IgE contenus dans des échantillons provenant de patients américains, la sensibilisation à Phoma arrivait au deuxième rang après celle au Botrytis {1893}.
Des réactions allergiques spécifiquement associées à une exposition en milieu intérieur à Phoma sp. ont été rapportées.
Plus de détails
Dans des écoles aux prises avec des problèmes d’humidité, Taskinen et al. ont identifié 6 enfants sur les 99 étudiés, dont l’essai par cuti-réaction était positif; 2 de ces enfants régissaient aux extraits de Phoma herbarum {720}.
Une étude scandinave s’est penchée sur la prévalence des IgE spécifiques chez des enfants asthmatiques (précédemment soumis à l’essai par cuti-réaction), en utilisant l’épreuve du RAST : de 4 à 60 % des enfants réagissaient positivement au Phoma, selon le groupe clinique auquel ils appartenaient (classé selon la gravité des symptômes et les réactions précédant la cuti-réaction) {1399}. Une autre étude sérologique a été réalisée sur deux groupes de patients adultes (américains et européens), pour lesquels un diagnostic présomptif d’allergie aux moisissures avait été posé {1893}. Dans cette étude, l’épreuve du RAST avait été effectuée avec un panel élargi combinant les six allergènes fongiques standards et dix nouveaux genres de moisissures ; 73 % des sujets possédaient des anticorps IgE spécifiques dirigés contre au moins une des seize moisissures. De plus, dans le groupe américain, les taux de sensibilisation au Phoma et au Botrytis (dont les allergènes ne font pas partie des panels usuels) étaient les plus prévalents, démontrant l’utilité d’un panel élargi d’allergènes, adapté à la mycoflore locale.
Composés et mécanismes allergènes
Il n’y a pas de données publiées concernant les fractions allergènes de Phoma sp.
Pneumonite d'hypersensibilité
La pneumonite d’hypersensibilité de Type III (HP) associée à quelques espèces de Phoma a été rapportée dans un nombre restreint de cas.
Plus de détails
Des résultats sérologiques positifs confirmant la présence de précipitines anti-Phoma herbarum et anti-Aspergillusfumigatus ont été obtenus dans le cas d’une patiente de 72 ans, qui présentait des symptômes de pneumonite d’hypersensibilité {1680}.
À Sydney (Australie), Green a rapporté des résultats semblables chez quelques patients présentant une pneumonite interstitielle allergique présumée : dans le sérum de ces patients, on a trouvé des précipitines dirigées contre le Phoma violacea qui faisait partie d’espèces de moisissures isolées à partir d’un rideau de douche contaminé. Ce type de rideau pourrait constituer une source d’exposition respiratoire aux moisissures {1899}.
Effets toxiques (mycotoxicoses)
Aucune mycotoxicose confirmée, humaine ou animale, étant associée à Phoma n’a été rapportée. Cependant, dans le cas de la maladie nommée Onyalai, on a proposé que la consommation de sorgho contaminé par l’acide tenuazonique puisse être un facteur contribuant au développement de cette affection {3860}.
Plus de détails
L’Onyalai est une forme du syndrome de purpura thrombocytopénique idiopathique attribuable à un désordre alimentaire se produisant chez les noirs d’Afrique australe centrale. L’Onyalai est une maladie dont l’étiologie est inconnue. Une nutrition déficiente pourrait en être la cause. Une autre hypothèse retenue est qu’une mycotoxine produite notamment par le Phoma, l’acide tenuazonique, agirait probablement en tant qu’haptène et entraînerait cette forme de thrombocytopénie. Le rôle étiologique possible des mycotoxines présentes dans le millet, le sorgho ou le maïs contaminés reste à étudier {3859}.
Infection et colonisation
Les espèces de Phoma sont rarement pathogènes pour les humains et pour les animaux. De fait, jusqu’en 2001, seulement 13 cas d’infections humaines à Phoma, affectant principalement la peau et les tissus sous-cutanés, ont été rapportés dans la littérature {1878}. Phoma cause habituellement des lésions superficielles de la peau, en général érythémateuses, prurigineuses et formant des croûtes {1885}. Cependant, des infections opportunistes (du groupe des phaeohyphomycoses) menant à des infections respiratoires et sous-cutanées ainsi qu’à des kératites ont été parfois rapportées {1879, 813, 818, 816, 1933}.
Pendant les 30 dernières années, des espèces de Phoma ont été isolées à plusieurs reprises dans des échantillons cliniques. Cet état de choses souligne l’augmentation graduelle de l’importance de ce mycète comme microbe pathogène opportuniste chez l’homme {1931, 1892}. Les individus ayant un système immunitaire affaibli ou ayant subi des blessures sont particulièrement à risque {1932, 1696, 816}; des auteurs soulignent l’existence d’infections cutanées provoquées par ce mycète chez des patients présentant une perte des défenses locales au niveau de la peau ou chez des patients chroniquement immunosupprimés {1885}.
Cependant, les infections à Phoma associées à une exposition par inhalation semblent extrêmement rares.
Plus de détails
Les infections cutanées et superficielles attribuables à Phoma semblent se produire seulement sur les parties exposées, soit le visage, les mains et les pieds. Cette situation suggère que ces infections sont le résultat d’inoculations mineures locales de matériel contaminé; typiquement, le mycète est introduit dans la peau lors d’un traumatisme {1878}. Par exemple, un cas de phaeohyphomycose a été rapporté chez un homme de 45 ans sans déficience immunologique connue; cependant, ses mains avaient fréquemment subi des lacérations mineures et des abrasions et étaient fréquemment en contact avec de la terre et des produits végétaux {1890}. En Inde, le Phoma sorghina a été rapporté comme agent étiologique de deux cas singuliers : le cas d’un jeune homme présentant des lésions papulovésiculaires érythémateuses sur le visage, le cou et les mains, ainsi que le cas d’un homme qui avait des taches sur tout le visage {1892}.
Un affaiblissement du système immunitaire induit par des traitements médicamenteux peut expliquer quelques infections à Phoma. Le Phoma minutella a été identifié comme agent étiologique d’une phaeohyphomycose sous-cutanée présente sur le pied d’un fermier soumis à un traitement aux corticostéroïdes pour une myasthénie grave (MG oumyasthenia gravis en latin) {1931}. Un autre cas de phaeohyphomycose sous-cutanée (lésions nodulaires de la peau avec érythème violacé dans la partie dorsale de la main droite) a été rapporté chez un homme souffrant de sarcoïdose pulmonaire et soumis à un traitement aux corticostéroïdes {1933}. Everett et al. {1885} ont rapporté une infection àPhoma dans la main d’un patient de 50 ans, immunosupprimé chronique, qui avait subi une greffe rénale. Toutefois, aucune histoire de blessure précédant l’infection n’a été rapportée; cette infection agressive et profondément envahissante a nécessité un débridement chirurgical. Un cas semblable a été rapporté chez un autre greffé du rein, agronome de profession, qui a développé une infection sous-cutanée localisée aux deux avant-bras, suivant une blessure subie un an après sa greffe rénale {1932}.
Un cas rare de kératite a été rapporté chez un homme de 72 ans; l’infection a eu lieu peu de temps après un traumatisme {1878}.
En 2006, un cas mortel d’infection pulmonaire à Phoma exigua a été rapporté chez un patient souffrant de leucémie myéloïde aiguë et de diabète {1879}; ce cas était seulement la deuxième infection respiratoire à Phoma rapportée dans la littérature {3868}.
Facteur de virulence
Aucun facteur de virulence particulier n’a été rapporté dans le cas des Phoma spp.
Milieux particuliers
Infections nosocomiales
Aucun cas d’infection nosocomiale à Phoma n’a été rapporté dans la littérature.
Maladies professionnelles
Aucun cas de maladie attribuable à Phoma, associé strictement au milieu du travail, n’a été rapporté dans la littérature.
Cependant, une étude mentionne la survenue de plusieurs symptômes chez des ouvriers exposés à Phoma et à d’autres mycètes dans un bâtiment contaminé.
Plus de détails
Dans ce cas, les employés ont été exposés aux mycètes dans un bain public fortement contaminé où Phoma était parmi les trois espèces dominantes; les employés ont éprouvé, entre autres, plusieurs symptômes allergiques et de l’irritation aux yeux, au nez et à la gorge ainsi que des maux de tête, du vertige, etc.; tous ces symptômes étaient liés à l’exposition aux moisissures {449}. Les premiers travaux de décontamination ont supprimé la plupart des signes évidents de moisissures. Conséquemment, le nombre de symptômes a diminué. Les seconds travaux ont permis de nettoyer efficacement le bâtiment; le taux de symptômes et les valeurs des débits de pointe sont ensuite retombés à des niveaux normaux.
Outils de diagnostic
Histopathologie
La présentation histologique des infections sous-cutanées attribuables au Phoma est typiquement celle d’une phaeohyphomycose profonde. Dans un cas d’infection particulièrement agressive et profondément envahissante à Phoma, les sections histologiques, obtenues à partir du tissu synovial des quatrième et cinquième compartiments dorsaux de la main, ont indiqué la présence d’hyphes envahissants. L’examen détaillé des sections colorées à l’imprégnation argentique de Gomori-Grocott a révélé la présence de filaments ramifiés et de pycnidies {1885}.
Dans un cas d’infection de la cornée, l’examen histopathologique a indiqué la présence, au bord de la cornée perforée, de sphérules d’un diamètre variable (5-30 µm) mélangées à des hyphes septés {1878}.
Dans le cas d’une infection pulmonaire mortelle à Phoma exigua chez un patient leucémique et diabétique, une masse importante a été enlevée, et l’examen des coupes colorées à l’hématoxyline-éosine a révélé la présence de larges hyphes septés, à parois épaisses, dans le tissu du poumon {1879}.
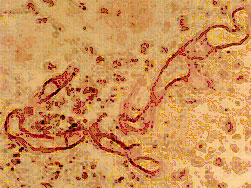
Tissu du poumon {1879}.
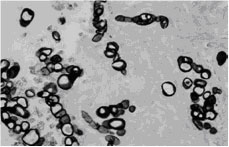

Une kératomie montrant le détachement de l’épithélium (haut, gauche); les larges sphérules du mycète sont visibles dans la couche superficielle (acide périodique Schiff x 40) {1879}. Sphérules parmi de courts hyphes septés, dans la couche profonde de la cornée, au point de perforation. (Grocott-méthénamine x 128) {1878}.
Immunodiagnostic
Les préparations commerciales courantes utilisées in vivo et in vitro sont des extraits de Phoma herbarum pour les cuti-réactions et de Phoma betae (m13) pour les tests sérologiques {3284, 581}.
Plus de détails
Les extraits allergènes de Phoma font partie du programme américain de surveillance de la Federal Drug Administration (FDA) des États-Unis et du Biological Products Deviation Reporting. Non-Blood Product Codes (registre des substances biologiques fongiques recevant les rapports concernant la non-conformité de produits [traduction libre]) {3285}.
- GK45 – Phoma betae
- GK46 – Phoma destructiva
- GK47 – Phoma herbarum
- GK48 – Phoma hibernica
- GK49 – Phoma sp.
Liste constituée à partir du registre de l’année 2008 de la Federal Drug Administration (FDA), qui permet de faire le suivi des substances biologiques homologuées, soit le Biological Products Deviation Reporting. Non-Blood Product Codes {3285}.
Épreuves immunodiagnostiques disponibles
| Épreuve | IgE | IgG | Antigènes | Autre |
|---|---|---|---|---|
| Cuti-réactions | X | |||
| RAST-IgE | X | |||
| RAST-IgG | N/D | |||
| ELISA-ELIFA | ||||
| Immunodiffusion | N/D | |||
| Immunofluorescence | N/D | |||
| Fixation du complément | N/D | |||
| PCR | Expérimental | |||
| Autre |
Bibliographie
- 412. Larone, D H. (1987). Medically important fungi. A guide to identification. 2nd edition, -230 p. New York - Amsterdam - London, Elsevier Science Publishing Co., Inc.
- 415. St-Germain, G and Summerbell, R. (1996). Champignons filamenteux d'intérêt médical. Caractéristiques et idenfication. -314 p. Belmont, Star Publishing Company.
- 449. Ebbehoj, N. E., Hansen, M. O., Sigsgaard, T., and Larsen, L. (2002). Building-related symptoms and molds: a two-step intervention study. Indoor Air. 12[4], 273-277.
- 479. Malloch, D. (1997). Moulds: isolation, cultivation, identification. http://www.botany.utoronto.ca/ResearchLabs/MallochLab/. University of Toronto. 6-22-0000.
- 581. Pharmacia Diagnostics AB. (2007). Allergy & autoimmunity. Diagnostics product catalogue 2007. internet, 1-48. Pharmacia.
- 587. Krause, M., Geer, W., Swenson, L., Fallah, P., and Robbins, C. (2006). Controlled study of mold growth and cleaning procedure on treated and untreated wet gypsum wallboard in an indoor environment. J Occup.Environ Hyg. 3[8], 435-441.
- 594. Claeson, A. S., Levin, J. O., Blomquist, G., and Sunesson, A. L. (2002). Volatile metabolites from microorganisms grown on humid building materials and synthetic media. J Environ Monit. 4[5], 667-672.
- 720. Taskinen, T., Meklin, T., Nousiainen, M., Husman, T., Nevalainen, A., and Korppi, M. (1997). Moisture and mould problems in schools and respiratory manifestations in schoolchildren: clinical and skin test findings. Acta Paediatr. 86[11], 1181-1187.
- 813. EMLAB. (2007). Environmental Microbiology Laboratory, Inc. (EMLab): An index of some commonly encountered fungal genera.
- 816. Patterson, T. F., McGinnis, M. R., and ed. (2009). The fungi :description. Site Doctor Fungus. Mycoses Study Group.
- 818. Friedman, D. (2007). Mold atlas of indoor clinical mold, pathogens, allergens and other indoor particles - medical health effects of mold, house dust, fiberglass, animal dander, insect fragments, etc. http://www.inspect-ny.com/mold/moldatlas.htm.
- 864. Beaumont, F., Kauffman, H. F., de Monchy, J. G., Sluiter, H. J., and de Vries, K. (1985). Volumetric aerobiological survey of conidial fungi in the North-East Netherlands. II. Comparison of aerobiological data and skin tests with mould extracts in an asthmatic population. Allergy. 40[3], 181-186.
- 930. Abdel-Hafez, S. I. and Shoreit, A. A. (1985). Mycotoxins producing fungi and mycoflora of air-dust from Taif, Saudi Arabia. Mycopathologia. 92[2], 65-71.
- 989. Centre de recherche sur la conservation des documents graphiques. (2007). Moisissures et biens culturels. Ministère de la culture et de la Communication, France.
- 1056. Samson, RA, Hoekstra, ES, and Frisvad, JC. (2004). Introduction to food and airbone fungi. 7th, -389 p. Baarn, Centralalbureau voor Schimmellcultures, Institute of the Royal Netherlands Academy of Arts and Sciences.
- 1193. Nolard, N., Beguin, H., and Chasseur, C. (2001). [Mold allergy: 25 years of indoor and outdoor studies in Belgium]. Allerg.Immunol.(Paris). 33[2], 101-102.
- 1281. Levetin, E. and Dorsey, K. (2006). Contribution of leaf surface fungi to the air spora. Aerobiologia 22[1], 3-12.
- 1399. Koivikko, A., Viander, M., and Lanner, A. (1991). Use of the extended Phadebas RAST panel in the diagnosis of mould allergy in asthmatic children. Allergy. 46[2], 85-91.
- 1680. Moran, J. V., Greenberger, P. A., and Patterson, R. (2002). Long-term evaluation of hypersensitivity pneumonitis: a case study follow-up and literature review. Allergy Asthma Proc. 23[4], 265-270.
- 1696. Mold & Bacteria Consulting Laboratories (MBL) Inc. (2005). Indoor mould: do not panic! Indoor Mold and Bacteria [June, 30].
- 1788. Gioulekas, D., Damialis, A., Papakosta, D., Spieksma, F., Giouleka, P., and Patakas, D. (2004). Allergenic fungi spore records (15 years) and sensitization in patients with respiratory allergy in Thessaloniki-Greece. J Investig.Allergol.Clin Immunol. 14[3], 225-231.
- 1817. Tarlo, S. M., Fradkin, A., and Tobin, R. S. (1988). Skin testing with extracts of fungal species derived from the homes of allergy clinic patients in Toronto, Canada. Clin Allergy. 18[1], 45-52.
- 1821. Rogers, S. A. (1984). A 13-month work-leisure-sleep environment fungal survey. Ann Allergy. 52[5], 338-341.
- 1824. Kozak, P. P., Gallup, J., Cummins, L. H., and Gillman, S. A. (1979). Factors of importance in determining the prevalence of indoor molds. Ann Allergy. 43[2], 88-94.
- 1878. Rishi, K. and Font, R. L. (2003). Keratitis caused by an unusual fungus, Phoma species. Cornea. 22[2], 166-168.
- 1879. Balis, E., Velegraki, A., Fragou, A., Pefanis, A., Kalabokas, T., and Mountokalakis, T. (2006). Lung mass caused by Phoma exigua. Scand.J Infect Dis. 38[6-7], 552-555.
- 1883. Lugauskas, A., Raila, A., Railiene, M., and Raudoniene, V. (2006). Toxic micromycetes in grain raw material during its processing. Ann Agric Environ Med. 13[1], 147-161.
- 1885. Everett, J. E., Busick, N. P., Sielaff, T., Wahoff, D. C., and Dunn, D. L. (2003). A deeply invasive Phoma species infection in a renal transplant recipient. Transplant.Proc. 35[4], 1387-1389.
- 1890. Hirsh, A. H. and Schiff, T. A. (1996). Subcutaneous phaeohyphomycosis caused by an unusual pathogen: Phoma species. J Am Acad Dermatol. 34[4], 679-680.
- 1892. Rai, M. K. (1989). Phoma sorghina infection in human being. Mycopathologia. 105[3], 167-170.
- 1893. Karlsson-Borga, A., Jonsson, P., and Rolfsen, W. (1989). Specific IgE antibodies to 16 widespread mold genera in patients with suspected mold allergy. Ann Allergy. 63[6 Pt 1], 521-526.
- 1899. Green, W. F. (1972). Precipitins against a fungus, Phoma violacea, isolated from a mouldy shower curtain in sera from patients with suspected allergic interstitial pneumonitis. Med J Aust. 1[14], 696-698.
- 1931. Baker, J. G., Salkin, I. F., Forgacs, P., Haines, J. H., and Kemna, M. E. (1987). First report of subcutaneous phaeohyphomycosis of the foot caused by Phoma minutella. J Clin Microbiol. 25[12], 2395-2397.
- 1932. Kalyani, M., Ranjitham, M., Sekar, U., Indhumathy, and Soundarajan, P. (2006). Subcutaneous infection by Phoma species in a renal allograft recipient - A case report. Indian Journal for the Practising Doctor 3[1].
- 1933. Zaitz, C., Campbell, I., Moraes, J. R., Moraes, M. E., Gouvea, C., Romero, M., Gouvea, N., Sadahiro, A., Chamone, D., and Dorlhiac, P. (1996). HLA-associated susceptibility to chronic onychomycosis in Brazilian Ashkenazic Jews. Int J Dermatol. 35[9], 681-682.
- 3147. Torres-Rodriguez, J. M., Lowinger, M., Corominas, J. M., Madrenys, N., and Saballs, P. (1993). Renal infection due to Absidia corymbifera in an AIDS patient. Mycoses. 36[7-8], 255-258.
- 3284. Hollister-Stier Laboratories. (2009). Allergenic extracts : Molds. Hollister-Stier Laboratories.
- 3285. Federal Drug Administration (FDA). (2008). Biological products deviation reporting (BPDR). Non-blood product codes. 3-29-2009.
- 3318. UniProt Consortium. (2009). Taxonomy : fungi metazoa group. Site de UniProt. 4-6-2009.
- 3729. Flannigan, B., Samson, R. A., and Miller, J. D. (2002). Microorganisms in home and indoor work environments: diversity, health impacts, investigation and control. -504 p. CRC Press.
- 3841. Van der AA, H. A., Noordeloos, M. E., and de Gruyter, J. (1990). Species concepts in some larger genera of the Coelomycetes. [32]. Studies in Mycology No. 32.
- 3842. Kendrick, B. and Murase, G. (2003). Anamorph-teleomorph dabase. CBS. Centraalbureau voor Schimmelcultures. 2009.
- 3853. Osono, T. (2006). Role of phyllosphere fungi of forest trees in the development of decomposer fungal communities and decomposition processes of leaf litter. Can.J Microbiol. 52[8], 701-716.
- 3855. Rai, M., Deshmukh, P., Gade, A., Ingle, A., Kovics, G. J., and Irinyi, L. (2009). Phoma Saccardo: Distribution, secondary metabolite production and biotechnological applications. Crit.Rev.Microbiol. 35[3], 182-196.
- 3859. Hesseling, P. B. (1992). Onyalai. Baillieres.Clin.Haematol. 5[2], 457-473.
- 3860. Rabie, C. J., van Rensburg, S. J., Van Der Watt, J. J., and Lubben, A. (1975). Onyalai--the possible involvement of a mycotoxin produced by Phoma sorghina in the aetiology. S.Afr.Med J. %20;49[40], 1647-1650.
- 3861. Boerema, G. H. (2004). Phoma Identification Manual: Differentiation of Specific and Infra-specific Taxa in Culture.
- 3866. Cole, R. J., Jarvis, B. B., and Schweikert, M. A. (2003). Handbook of secondary fungal metabolites. [3]. Amsterdam, Academic Press.
- 3867. Weidenb÷rner, M. (2001). Pine nuts: the mycobiota and potential mycotoxins. Can.J.Microbiol. 47, 460-463.
- 3868. Morris, J. T., Beckius, M. L., Jeffery, B. S., Longfeld, R. N., Heaven, R. F., and Baker, W. J. (1995). Lung mass caused by Phoma species. Infectious Diseases in Clinical Practice 4[1], 58-59.
- 3870. Burge, H (1995). Bioaerosols. 319 p.
- 3871. Buisseret, P. D. (1976). Seasonal allergic symptoms due to fungal spores. Br.Med J. 2[6034], 507-508.
- 3965. Huang, L. H. and Hanlin, R. T. (1975). Fungi occurring in freshly harvested and in-market pecans. Mycologia. 67[4], 689-700.
- 3966. Pitt, J. I., Hocking, A. D., Bhudhasamai, K., Miscamble, B. F., Wheeler, K. A., and Tanboon-Ek, P. (1993). The normal mycoflora of commodities from Thailand. 1. Nuts and oilseeds. Int.J Food.Microbiol. 20[4], 211-226.
- 3967. Joffe, A. Z. (1969). The mycoflora of fresh and stored groundnut kernels in Israel. Mycopathol.Mycol.Appl. 39, 255-264.
- 3968. Weidenbörner, M. and Hindorf, H. (1989). Fungi isolated from protein enriched seeds and pods with special emphasis on the genus Aspergillus. Sci & Technol. 17[2], 383-390.
- 3972. Beguin, H. and Nolard, N. (1996). Prevalence of fungi in carpeted floor environment: analysis of dust samples from living-rooms, bedrooms, offices and school classrooms. Aerobiologia 12, 113-120.
- 3973. Visconti, A., Logrieco, A., Vurro, M., and Bottalico, A. (1987). Tenuazonic acid in blackmold tomatoes: occurrence, production by associated Alternaria species, and phytotoxic properties. Phytopatol.Mediterran. 26, 125-128.