Aspergillus fumigatus
Introduction
L’Aspergillus fumigatus a été associé à chacun des types de problèmes de santé attribués aux moisissures environnementales : irritation et inflammation, allergie, asthme, pneumonite, effets toxiques ainsi que toute la gamme des infections fongiques.
Des infections ont été rapportées touchant chaque site anatomique et chaque type de tissu, excepté les ongles. L’Aspergillus fumigatus est l’agent principal de l’aspergillose chez les patients présentant une altération de l’immunité naturelle. L’exposition à cette espèce se fait la plupart du temps par l’inhalation d’air contaminé par les moisissures présentes sur de la matière végétale en décomposition, des grains contaminés ou des aérosols d’eaux résiduaires.
Taxonomie
| Règne | Fungi | Famille | Trichomaceae |
| Phylum | Ascomycota | Genre | Aspergillus |
| Classe | Eurotiomycetes | Espèce | fumigatus |
| Ordre | Eurotiales |
Il y a plus de 200 espèces nommées d’Aspergillus {3318}. L’International Mycological Association (Association internationale de mycologie) {3971} a répertorié 799 espèces et souches d’Aspergillus dans sa banque de données. L’Aspergillus fumigatus a été la première espèce officiellement décrite en 1863. Le registre de MycoBank indique jusqu’à dix-sept variétés de cette espèce. Ce mycète anamorphe ne comporte aucun stade télémorphe reconnu.
Écologie
Ce mycète est un saprophyte de répartition mondiale, fréquemment isolé à partir du sol, de la matière végétale en décomposition, du compost, des copeaux de bois, du foin et des grains engrangés {1089, 989, 1052}. Cette espèce se développe bien à des températures allant jusqu’à 45 °C, ou même à des températures plus élevées, et constitue un des microorganismes les plus communs présents dans la tourbe, le compost et tout autre matériel organique se décomposant à des températures élevées.
Plus de détails
L’A. fumigatus a été trouvé associé aux sites de nidification des oiseaux, tant dans les débris de nids d’oiseaux que sur leurs perchoirs, dans leurs plumes, dans leurs fientes de même que dans l’air des poulaillers {3971}. Ce mycète a été décelé dans des milieux humides, aussi bien dans des milieux d’eau douce que dans des milieux d’eau de mer, ainsi que dans des terrains marécageux, des plages de sable, des sols salins et des marais de palétuviers. Il a également été isolé dans les eaux d’égout ainsi que dans les boues activées et les boues résiduelles des papeteries {3971}.
L’A. fumigatus se développe également bien sur les substrats organiques en milieu intérieur tels que la poussière, les panneaux de gypse ou tout autre matériau de construction contenant de la cellulose; il est aussi trouvé dans les systèmes d’humidification et de climatisation ainsi que dans les conduits de ventilation et les systèmes de filtration d’air. Il peut aussi croître sur des articles ménagers composés de toile, de cuir ou de papier. {989, 413}.
La propagation de cette espèce se fait par la dispersion de spores sèches par l’entremise du vent.
Exigences de croissance
L’A. fumigatus est une espèce thermotolérante et thermophile qui est capable de pousser entre 12 et 57 °C (en moyenne à une température variant entre 37 et 43 °C); sa croissance maximale est atteinte in vitro lorsqu’elle est incubée à 37 °C, à un pH allant de 3 à 8. Une quantité d’eau libre minimale (Aw), variant entre 0,82 et 0,97 (Aw = 0,90), est nécessaire pour permettre à l’espèce de germer et de se développer {989, 413}; ce mycète demeure viable à des températures allant jusqu’à 70 °C {812} et il peut survivre à la pasteurisation {63} pendant 25 minutes {989}.
Selon les auteurs, l’exigence minimale en eau (Aw) varie, pour la croissance de cette espèce, entre 0,85 et 0,94 {989, 3729}; la plupart des auteurs considèrent que l’Aspergillus fumigatus est un colonisateur tertiaire.
Activité de l’eau : Aw = 0,85-0,94
Croissance sur matériaux de construction et en environnement intérieur
A. fumigatus se développe aisément dans l’environnement intérieur sur des matériaux de construction mouillés (panneaux de placoplâtre, bois, carton gris, panneaux de plafond cartonnés et matériaux d’isolation); sur ces matériaux, ce mycète produit habituellement une zone de croissance de taille moyenne grise à gris vert {595}. L’A. fumigatus a également été trouvé sur les matériaux isolants cellulosiques appliqués par giclage humide; ces matériaux sont également appelés wet spray-applied cellulose insulation (WSACI) {670}.
L’A. fumigatus se développe également bien sur les substrats organiques en milieu intérieur tels que la poussière domestique et sur tout matériau de construction contenant de la cellulose; il se développe aussi dans les humidificateurs, les systèmes de climatisation, les conduites de ventilation et les systèmes de filtration d’air. Ce mycète peut également contaminer des articles usuels composés de toile, de cuir ou de papier {989, 413}.
Laboratoire
La manipulation des cultures de ce genre doit se faire en respectant les précautions de laboratoire de base (niveau de biosécurité 2).
Morphologie macroscopique des colonies
Les colonies se développent modérément à 25 °C sur gélose à l’extrait de malt (MEA) ou sur gélose pomme de terre (PDA); les colonies atteignent 25 µm de diamètre en dedans de cinq jours. Une colonie issue d’un point unique d’inoculation, incubée à 37 °C, aura un diamètre de 40 à 60 mm en sept jours.
Les colonies sont plates ou légèrement plissées et plutôt rases, denses et veloutées; le mycélium aérien est vert bleuté. À maturité, la surface des colonies devient cotonneuse. Le revers de la colonie est pourpre avec une frange blanche {724}; il y a parfois la présence d’un pigment pourpre diffusible dans la gélose.
À un faible grossissement, les têtes de conidies apparaissent en surface nettement radiales en début de croissance; plus tard, à maturité, les têtes sont compactes, et les chaînes de conidies sont en colonnes serrées.
Morphologie microscopique
Au microscope, la structure principale de la tête de conidies est le conidiophore. Le conidiophore est formé d’une longue cellule ovale ou stipe mesurant 200-400 µm de long, parfois sinueuse à parois lisses, minces et hyalines; cette cellule s’élargit graduellement en une vésicule piriforme souvent verdâtre (20-30 µm de diamètre). Les vésicules sont fertiles à l’apex sur au moins la moitié de leur surface; elles portent de nombreuses phialides {2943} agencées de façon compacte; les phialides latérales sont recourbées vers le haut de façon à se retrouver presque parallèles à l’axe central du conidiophore. Ainsi, toutes les phialides pointent dans la même direction.
Les conidies sont sphériques à subsphériques, mesurent 2,5-3,0 µm de diamètre et sont à parois finement rugueuses et échinulées. Parfois, les chaînes de conidies peuvent être portées directement sur la vésicule au lieu d’être produites par une phialide intermédiaire {372, 991, 724}.
Métabolites spécifiques
L’Aspergillus fumigatus est l’espèce d’Aspergillus la plus importante parmi celles associées à des problèmes de santé. Ce mycète produit un grand nombre de substances, y compris des métabolites secondaires, des acides et des protéines telles que les hydrophobines, et des enzymes extracellulaires. Au moins 226 métabolites secondaires de l’A. fumigatus, ayant potentiellement une activité biologique, ont été décrits et peuvent être classés dans 24 familles de produits de biosynthèse {4120}.
Neuf « composés organiques volatils microbiens uniques » (umCOV) ont pu être élaborés par de l’Aspergillus cultivé expérimentalement sur des panneaux de gypse et ont pu être détectés en concentrations suffisantes pour être décelables. Parmi ces substances se trouvaient le méthyl butanol, le méthyl propanol, l’heptanone, l’hexanone et l’octanone {598}.
Dans les bâtiments humides, plusieurs composés organiques, y compris des composés organiques volatils microbiens (MCOV), ont été associés à plusieurs espèces fongiques. Certains de ces composés sont communs à la plupart des espèces fongiques et contribuent probablement aux différents problèmes de santé liés à la qualité de l’air intérieur. Toutefois, plusieurs des métabolites fongiques identifiés sont non réactifs et sont en faibles concentrations dans l’air intérieur {594}.
Mycotoxines
L’Aspergillus fumigatus est le producteur reconnu d’un grand nombre de mycotoxines. Plusieurs mycotoxines produites par l’A. fumigatus peuvent être nocives pour l’homme et les animaux. Selon la nature du substrat, les conditions environnementales et la souche donnée, l’Aspergillus fumigatus peut produire de nombreuses toxines, principalement les fumigaclavines, la fumigatine, la fumigatoxine, la fumitoxine et la fumitrémorgine {989}. L’A. fumigatus produit aussi une toxine puissante agissant sur le système immunitaire, soit la gliotoxine. D’autres toxines peuvent aussi être générées par ce mycète telles que la déchloroniduline, l’acide helvolique, l’acide phthioique, la restrictocine, la tryptoquivaline A, le verruculogène et la viriditoxine.
Certaines toxines, telles que la festuclavine, la chanoclavine, les fumitrémorgènes et les fumitoxines, ont été étudiées chez l’animal sur des lignées cellulaires; certaines de ces toxines peuvent causer la mort des poulets et des tremblements chez divers animaux {777, 779}. Certaines substances étudiées seulement in vitro, comme la fumifungine, se sont révélées être des substances antifongiques efficaces. D’autres mycotoxines de l’Aspergillus fumigatus ont été isolées, mais elles n’ont pas encore été étudiées.
L’A. fumigatus produit également quelques toxines communes à plusieurs moisissures; parmi ces toxines se trouve la gliotoxine qui est une substance génotoxique, cytotoxique, immunosuppressive et mutagène efficace.
Plus de détails
La gliotoxine peut être générée sur du bois, des panneaux de gypse ou du carton gris. Dans une étude, elle a été décelée sur des matériaux de construction endommagés expérimentalement par l’A. fumigatus; les concentrations variaient selon le matériau de construction examiné, soit de 1 à 40 ng de gliotoxine par centimètre carré. Selon ces résultats, la quantité de gliotoxine présente sur une surface de 100 cm² de panneau de gypse pourrait réduire la fréquence du battement ciliaire de la muqueuse respiratoire; ce mécanisme serait mis en cause dans la cytotoxicité de la gliotoxine {595}.
D’autres métabolites secondaires pourraient avoir des effets nocifs chez l’homme et les animaux. Parmi ces métabolites se trouvent la brévianamide f phenyltransférase, le canescin, le déchloronidulin, l’isotryptoquivaline, le méthyl sulochrin, la norisotryptoquivaline, le pyripropène A, la sphingofungine A, la spinulosine, le tripacidin ainsi que le composé nommé « tryptoquivaline N/ déoxynortryptoquivalone/ déoxytryptoquivaline B/ fumitrémorgine N » {812}.
En milieu intérieur, l’A. fumigatus peut produire des toxines sur des matériaux et des finis communs tels que les surfaces peintes au latex. De plus, l’A. fumigatus peut accumuler des toxines du même type que les alcaloïdes de l’ergot de seigle, sous une forme respirable, dans ses conidies ou sur ces dernières; des chercheurs ont pu mesurer des alcaloïdes d’ergots de seigle liés aux conidies, produits sur plusieurs substrats différents, et en évaluer les propriétés physiques. Au moins quatre alcaloïdes de l’ergot de seigle ont été trouvés associés aux conidies de l’A. fumigatus, soit la fumigaclavine C, la festuclavine, la fumigaclavine A et la fumigaclavine B (par ordre d’abondance). Quand les conditions environnementales les plus favorables sont réunies, toute la masse des alcaloïdes de l’ergot de seigle peut souvent constituer plus de 1 % de la masse des conidies. Ces alcaloïdes ont pu être extraits à partir des conidies générées sur tous les milieux examinés, et les plus grandes quantités ont été observées lorsque le mycète était cultivé sur une surface peinte au latex ou sur des plantules de maïs. {4110, 765}.
Les souches d’Aspergillus fumigatus, isolées à partir d’échantillons cliniques humains, animaux ou environnementaux, peuvent produire des toxines. De plus, les études expérimentales réalisées sur des isolats provenant d’infections suggèrent que la production endogène des toxines lors des infections pulmonaires humaines et d’aspergillomes peut contribuer à la pathogénicité de cet Aspergillus {4160}.
Une étude a été menée en République de Croatie chez onze patients adultes (sept hommes et quatre femmes), traités chirurgicalement pour un aspergillome pulmonaire, sur une période de deux ans. L’analyse mycologique réalisée sur cinq échantillons de tissus prélevés chirurgicalement a révélé la présence d’Aspergillus dans tous les cas : Aspergillus fumigatus (3/5) et Aspergillus versicolor (2/5). Le pouvoir toxinogène de ces espèces a été déterminé par chromatographie. Les trois souches d’A. fumigatus produisaient de l’aflatoxine B1, et deux de ces souches produisaient de l’aflatoxine G1. Quant aux deux souches d’A. versicolor, elles produisaient de l’AFB1 et de la stérigmatocystine. Aucune souche isolée n’élaborait de l’aflatoxine G2 ou de l’ochratoxine A. La croissance fongique et la production des mycotoxines dépendent de l’interaction du mycète, de son hôte et de l’environnement. Il faut donc se souvenir qu’une souche d’Aspergillus fumigatus élaborant des mycotoxines in vitro ne produira pas nécessairement les mêmes toxines dans des tissus humains {4160}.
Problèmes de santé
Les problèmes de santé associés à une exposition à l’Aspergillus fumigatus couvrent l’éventail complet des maladies fongiques. Ce qui importe le plus est que l’Aspergillus fumigatus est l’agent principal de l’aspergillose chez les patients dont l’immunité naturelle a été perturbée. Cette espèce cause une mycose typique par inhalation, c’est-à-dire une colonisation suivie, dans certains cas, par une invasion des tissus et, occasionnellement, par des réactions allergiques. D’autres types d’infections peuvent survenir chez les sujets immunosupprimés, mais elles se produisent très rarement au sein de la population générale.
L’Aspergillus fumigatus peut aussi engendrer d’autres problèmes de santé que les infections. Toutefois, les pathologies les plus graves attribuées à ce mycète sont les infections aiguës et chroniques du système respiratoire (aspergillose et aspergillome) chez l’homme et chez les animaux {4311}.
Ce mycète est l’agent de plusieurs maladies chez le bétail (avortement fongique) et chez les chevaux. L’aspergillose est une cause majeure de morbidité et de mortalité chez certaines espèces aviaires; l’aspergillose aviaire affecte autant les oiseaux en captivité que ceux élevés en liberté et peut causer la mort d’élevages entiers en captivité.
Irritation et inflammation
Il est généralement accepté que plusieurs composantes structurales fongiques, communes à toutes les moisissures, puissent induire des irritations et de l’inflammation.
Plusieurs symptômes respiratoires non spécifiques peuvent survenir à la suite d’une exposition à l’Aspergillus tout comme aux autres moisissures environnementales; les symptômes d’irritation ou d’inflammation comprennent de la rhinite, des sécrétions, de la toux nocturne et, dans certains cas, les sujets exposés peuvent ressentir de l’irritation aux yeux ou sur la peau. {2740, 142, 165, 2553, 2111, 595, 566, 766, 946, 355, 154, 260}.
Réactions allergiques
L’Aspergillus fumigatus est considéré comme un agent commun des réactions allergiques, aussi bien dans un environnement extérieur que dans un environnement intérieur contaminé par des moisissures. {1982, 1420, 1399, 3047, 3840, 2019, 3561, 3839}.
L’A. fumigatus est reconnu comme pouvant produire des polypeptides allergènes causant la rhinite et l’asthme {675}, c’est-à-dire, des réactions allergiques de Type I aux spores et aux fragments de moisissures; ces réactions sont médiées par les IgE.
L’A. fumigatus peut causer une maladie, associée à la congestion nasale et à la rhinite allergique chronique, pouvant mener à des polypes nasaux {931}. L’A. fumigatus peut également engendrer de la rhinite et de l’asthme allergiques sans envahir les tissus, mais, dans certains cas, ces réactions allergiques peuvent résulter d’une croissance fongique dans les sécrétions bronchiques; cette croissance libère plus d’allergènes dans les bronches. L’affection qui en découle est appelée aspergillose bronchopulmonaire allergique (ABPA).
Plus de détails
L’aspergillose bronchopulmonaire allergique (ABPA) est une complication peu fréquente de l’asthme ou de la fibrose kystique, et l’identification rapide de cette maladie est importante pour éviter la progression des bronchiectasies et des dommages au parenchyme pulmonaire. Les patients touchés ont habituellement des anticorps spécifiques de type réagines (IgE) et, dans certains cas, ils présentent une infiltration pulmonaire disséminée. Jusqu’à 5 % des adultes asthmatiques pourraient être aux prises avec cette complication à un moment donné pendant leur vie. Cette maladie est commune chez les patients souffrant de fibrose kystique quand ils atteignent l’adolescence et l’âge adulte. Les symptômes sont semblables à ceux de l’asthme : épisodes intermittents de malaises, de toux et de respiration sifflante {3887}. Quelques patients crachent des bouchons de mucus brun {812}. Le diagnostic de cette affection, pour la plupart des patients atteints d’ABPA, sera posé en s’appuyant sur des critères cliniques et radiographiques, et des analyses de laboratoire. {226, 822, 275, 406, 174, 206, 233, 376}.
Composés et mécanismes allergènes
Plus de quarante composantes allergènes de l’Aspergillus fumigatus ont été étudiées chez des sujets humains ou en laboratoire {3912}.
Ces dernières années, plus de vingt gènes codant les antigènes d’A. fumigatus ont été clonés, et les protéines ont été exprimées. Parmi ces allergènes, les fractions Asp-f-1, Asp-f-2, Asp-f-3, Asp-f-4, et Asp-f-6 ont montré une forte affinité pour les IgE provenant des sérums de différents groupes de patients {186}. La fraction allergène la plus importante semble être Asp-f-1 : elle a été identifiée chez 85 % des patients atteints d’ABPA et chez la plupart des patients ayant une réaction positive au test intradermique {3912}.
Plus de détails
Les résultats disponibles suggèrent que l’ensemble des fractions Asp-f-2, Asp-f-3 et Asp-f-6 réagit davantage avec les IgE des patients présentant de l’asthme et une aspergillose bronchopulmonaire allergique (ABPA); les épreuves réalisées avec ces fractions sont moins efficaces pour mettre en évidence les IgE spécifiques des patients souffrant de fibrose kystique et d’ABPA. La structure moléculaire des allergènes joue également un rôle important dans la réponse immunologique des patients allergiques. Les techniques génomiques permettent de fabriquer des antigènes recombinants ayant plus ou moins d’affinités pour les IgE anti-Aspergillus présents chez les patients; de tels antigènes peuvent être très utiles en tant que réactifs spécifiques ou comme immunomodulateurs.
Des réactions immunologiques, à la fois aux allergènes et aux toxines, ont été reliées à l’ABPA {1287, 4144, 2481, 174, 560}. La fraction Asp-f-1 a été identifiée comme étant un allergène important de l’Aspergillus fumigatus et elle démontre une homologie avec quelques cytotoxines. Des chercheurs ont comparé diverses cytotoxines des espèces d’Aspergillus quant à leur réactivité à des anticorps IgE et à des IgG présents dans les sérums d’un groupe de patients atteints d’ABPA {4144}. Des niveaux plus élevés d’anticorps IgE et d’IgG dirigés contre tous les antigènes d’Aspergillus fumigatus et contre les ribotoxines ont été décelés chez la majorité des patients atteints d’ABPA; les niveaux présents chez les patients atteints d’ABPA étaient nettement plus élevés que chez les patients allergiques présentant de l’asthme et que chez les sujets en bonne santé. Ces résultats suggèrent que les cytotoxines jouent un rôle important dans la pathogénie de l’ABPA.
Pneumonite d'hypersensibilité
La pneumonite d’hypersensibilité (HP), ou alvéolite allergique extrinsèque, provoquée par l’A. fumigatus est l’une des maladies d’hypersensibilité les plus connues, qui sont associées à une exposition professionnelle; lorsqu’il résulte de la manipulation du foin moisi, ce syndrome s’appelle affection pulmonaire du fermier ou poumon du fermier (farmer’s lung disease en anglais ou FLD) {227, 854, 271, 1103, 3670, 1091, 2245}.
Plusieurs autres syndromes semblables sont associés à l’exposition à l’A. fumigatus présent dans des produits de nature organique, tels que les copeaux de bois (poumon des scieries) {265, 777, 854, 231} et les fibres de sparte contenues dans certains ouvrages de plâtre (poumon du plâtrier ou esparto lung en anglais) {208, 189, 246, 293, 4168}; la HP due au A. fumigatus a également été associée aux expositions en milieu intérieur à des matériaux de construction contaminés {846} et à de l’eau souillée stagnante {230}. La HP est une réaction immunitaire cellulaire d’hypersensibilité médiée par les IgG.
La gamme de symptômes rapportés comprend de la toux, de la dyspnée, une respiration sifflante {3887} et de l’oppression thoracique ainsi que des symptômes moins spécifiques de fatigue, de myalgie et un sentiment de malaise général {1100}. Le poumon du fermier (FLD) et les autres formes de HP peuvent mener à la fibrose interstitielle. La progression de la fibrose pulmonaire est extrêmement variable; certains sujets atteints de HP récupéreront complètement après une attaque aiguë ou de multiples attaques, alors que d’autres connaîtront des changements fonctionnels résiduels, même après un seul épisode aigu. Quelques sujets peuvent développer une fibrose progressive pulmonaire sans jamais avoir connu de phase aiguë de la maladie {979}. Dans de rares cas, les patients ont des manifestations systémiques typiques du poumon du fermier aigu, mais sans présenter les manifestations pulmonaires nécessaires pour confirmer ce diagnostic; il est à noter que, dans ces cas, les symptômes sont très différents de ceux du syndrome toxique aux poussières organiques (ODTS) {981}.
Effets toxiques (mycotoxicoses)
Des mycotoxines dérivées des espèces d’Aspergillus peuvent être générées dans les environnements résidentiels et professionnels, et l’exposition peut constituer des risques sanitaires graves. L’exposition aux mycotoxines peut se produire par voie alimentaire, par inhalation ou par contact direct avec la peau et les muqueuses.
Des problèmes de santé aigus et chroniques, de l’irritation, des réactions systémiques et peut-être même le cancer peuvent se développer après une exposition importante à ces toxines. Certaines mycotoxines agissent en tant qu’immunosuppresseurs, ce qui pourrait expliquer la plus grande prévalence des infections à répétition chez certains occupants des bâtiments ayant des problèmes d’humidité {3437}.
La plupart des cas rapportés de mycotoxicoses sont d’origine alimentaire. Chez l’homme, il y a très peu de cas documentés de mycotoxicoses par inhalation, et aucun cas de mycotoxicose attribuable à l’A. fumigatus, répondant à une définition clinique spécifique, n’a été rapporté. Toutefois, les toxines contenues dans les spores de l’A. fumigatus contribueraient à d’autres types de problèmes de santé associés aux moisissures ainsi qu’à la pathogénicité de ce mycète.
Conséquemment, étant donné que l’Aspergillus fumigatus a la capacité de produire plusieurs toxines nocives, le potentiel pathogène des métabolites de ce mycète ne peut être ignoré.
Plus de détails
La plupart des études sur les effets toxiques de l’Aspergillus fumigatus portent sur les mycotoxines trémorgènes et sur la gliotoxine {299}. En effet, un certain nombre de souches d’A. fumigatus peuvent produire ces types de toxines; une fois qu’elles sont administrées expérimentalement aux rats, ces toxines peuvent induire des réactions trémorgènes très fortes. Bien que ces mêmes toxines aient été identifiées dans des souches détectées dans des scieries suédoises et bien qu’elles soient susceptibles d’induire d’importants problèmes de toxicité en milieu de travail, aucun cas grave de mycotoxicose de ce type n’a pourtant été rapporté chez les ouvriers s’occupant de l’équarrissage {777, 779}.
Dans le cas de la gliotoxine, il a été démontré qu’elle peut même être produite en milieu intérieur sur du bois, des panneaux de gypse ou du carton gris. Dans les matériaux de construction expérimentalement contaminés par des moisissures, les niveaux de gliotoxine détectés variaient de 1 à 40 ng par centimètre carré, selon la nature du matériau de construction examiné. D’après ces résultats, la quantité de gliotoxine présente sur une surface de 100 cm² de panneau de gypse contaminé pourrait réduire la fréquence du battement ciliaire de la muqueuse respiratoire; ce mécanisme serait mis en cause dans la cytotoxicité de la gliotoxine {595}.
D’autres études portant sur les mycotoxicoses expérimentales chez les souris, les poussins et les porcs ont démontré que les toxines de l’Aspergillus fumigatus causent des œdèmes périrénaux chez les porcs {1243}.
Le verruculogène lié aux hyphes et aux conidies de l’Aspergillus fumigatus modifie les propriétés électrophysiologiques des cellules épithéliales nasales humaines; une étude a permis de vérifier que le verruculogène pouvait être produit par une collection de 67 souches de provenance humaine, animale et végétale. Les isolats toxiques d’A. fumigatus peuvent ainsi influer sur le déclenchement de la colonisation du système respiratoire {4140}.
Une autre étude a montré que le verruculogène pourrait être produit par les souches environnementales aéroportées et les souches cliniques d’Aspergillus fumigatus {300}. Dans les deux groupes, les chercheurs ont noté le pourcentage élevé de souches productrices de verruculogène (84 % des souches environnementales et 91 % des souches cliniques). La concentration de verruculogène était sensiblement la même dans les groupes d’isolats aéroportés (0,34 mg/mL) et d’isolats cliniques (0,26 mg/mL).
Une autre étude suggère l’existence d’un lien entre l’exposition environnementale aux moisissures toxiques (A. fumigatus étant l’une d’entre elles) en milieu intérieur et des cas de névrome mycotique acoustique chez des adolescents {711}; ce lien reste toutefois à éclaircir.
Infection et colonisation
L’Aspergillus fumigatus est de plus en plus souvent identifié comme microbe pathogène opportuniste chez les patients gravement immunocompromis. L’Aspergillus est l’agent infectieux le plus commun de la mortalité pneumonique chez les patients ayant subi une greffe de la moelle ou de cellules souches {2123}. Ces infections à Aspergillus sont difficiles à diagnostiquer avant la mort du patient (ante mortem) et sont souvent fatales {4134}.
Le site principal de la colonisation et de l’infection est le système respiratoire; les formes disséminées graves d’infections peuvent se propager au cerveau, aux os et au système circulatoire. D’autres sites d’infections incluent les sinus, les oreilles, les yeux, les reins et l’appareil gastro-intestinal {4270, 812, 415}.
Les infections non respiratoires sont peu fréquentes chez l’hôte en bonne santé parce qu’il a naturellement une plus grande résistance à l’infection {812}. Ainsi, l’A. fumigatus est habituellement isolé chez les patients immunocompromis, les patients greffés de même que chez les patients atteints de leucémie en phase aiguë, de maladies auto-immunes et du sida {299}. Les patients recevant des agents antimicrobiens, ceux soumis à un traitement aux stéroïdes ou les personnes infectées par certains autres types de microorganismes sont également à risque {406, 605}. L’aspergillose envahissante est une infection représentant un danger pour la vie des sujets à risque {1090, 673}.
Les populations pouvant davantage développer des affections graves sont les patients neutropéniques {683, 54, 363}, les patients ayant subi une transplantation {517, 685}; {258, 354, 491, 684, 990}, les patients recevant une chimiothérapie ou prenant des stéroïdes {338, 512} et les patients présentant une maladie granulomateuse, si elle est chronique {228}; mais des cas d’infection systémique ont aussi été parfois rapportés chez des patients sans maladie sous-jacente apparente {4312}.
Plus de détails
Aspergillome et colonisation pulmonaire chronique
L’A. fumigatus peut causer une maladie sans toutefois pénétrer les organes. Le mycète se développe dans une cavité du poumon précédemment formée pendant une maladie telle que la tuberculose ou la sarcoïdose; n’importe quelle affection pulmonaire qui génère des cavités peut rendre une personne {874} vulnérable à la formation d’un aspergillome : les spores pénètrent dans la cavité et germent, puis forment une boule fongique dans la cavité. Le mycète sécrète ensuite des produits toxiques et allergènes qui peuvent rendre la personne malade.
La personne affectée peut n’avoir aucun symptôme, surtout au début. Ensuite les symptômes les plus communs sont une perte de poids, une toux chronique, une sensation d’épuisement et de la fatigue.
Jusqu’à 50-80 % des personnes touchées peuvent présenter de la toux avec hémoptysie (présence de sang dans les expectorations). Le diagnostic se fait par des rayons X, par de la tomographie et par des analyses de sang {812}.
Les aspergillomes ou boules fongiques peuvent se former ailleurs que dans les poumons, par exemple dans les sinus. Dans ces cas, les sujets dont le système immunitaire est sain éprouveront souvent les symptômes suivants : de la congestion nasale, de la douleur aux sinus, des maux de tête chroniques ou de la douleur au visage. Le drainage des sinus par chirurgie règle habituellement le problème, à moins que l’Aspergillus n’ait pénétré par les sinus jusqu’à l’intérieur du crâne. À ce stade, les traitements antifongiques et la chirurgie sont les traitements de choix.
Aspergillose envahissante
En plus des sites d’infections reliés au système respiratoire, d’autres sites ont été décrits (les reins, les yeux, les oreilles, les sinus et l’appareil gastro-intestinal); toutefois, ces types d’infections ne surviennent que rarement chez les individus immunocompétents. De fait, la sinusite à Aspergillus est plus grave chez les patients dont le système immunitaire est perturbé; la sinusite prend alors la forme d’une aspergillose envahissante. Les symptômes incluent de la fièvre, de la douleur faciale, de l’écoulement nasal et des maux de tête. Le diagnostic est confirmé par la mise évidence du mycète dans les sécrétions et dans les tissus des sinus, ainsi que par les résultats de l’imagerie à balayage {812}.
Chez les personnes ayant un système immunitaire particulièrement affaibli, le mycète peut migrer des poumons par la voie sanguine jusqu’au cerveau ou vers d’autres organes, y compris les yeux, le cœur, les reins et la peau. Habituellement, cette dissémination est mauvais signe, car cette forme d’aspergillose est plus grave et la personne court alors un plus grand risque de décéder des suites de l’infection.
Cependant, dans certains cas, l’infection disséminée à la peau permet de poser un diagnostic plus tôt et de commencer rapidement le traitement {1090, 812}. Les gens présentant une aspergillose envahissante font habituellement de la fièvre et ont des symptômes pulmonaires tels que la toux et des douleurs thoraciques; ils éprouvent de l’inconfort, de l’essoufflement ou auront de la difficulté à respirer (dyspnée). Ce tableau clinique ne répond pas à l’antibiothérapie standard. Les images radiologiques et tomographiques sont habituellement anormales, et ces techniques aident à localiser la maladie. La bronchoscopie est souvent utilisée pour confirmer le diagnostic. Les cultures et les analyses de sang sont habituellement nécessaires pour établir l’étiologie de la maladie.
Infections de l’oreille, des sinus et de l’oeil
Des infections primaires de l’œil, de la conjonctive, des paupières et de l’orbite intraoculaire de même que de l’oreille externe ou des sinus ont été décrites. Ces types d’infections généralisées et disséminées, reliées à l’aspergillose, sont rares. Cette affection est habituellement diagnostiquée chez une personne aux défenses immunitaires très affaiblies {697}.
La simple colonisation, ailleurs que dans les poumons, peut se produire chez des patients moins débilités; c’est le cas des infections aux yeux {1246, 1247} et de la colonisation ou de l’infection des oreilles externes {4319}; il faut noter que l’Aspergillus fumigatus est un des agents les plus répandus de la sinusite fongique {820, 176}. La colonisation des sinus peut mener à une réponse allergique {273} et à l’apparition de boules fongiques, et elle peut même devenir envahissante; dans ces cas, de nombreuses complications peuvent survenir et être fatales {390}.
Facteur de virulence
Ce mycète joue un rôle essentiel dans la nature et il est omniprésent; il est continuellement inhalé par les humains et est éliminé efficacement par des barrières naturelles intactes et par un système immunitaire adéquat. Cependant, chez les hôtes immunocompromis, l’infection à Aspergillus fumigatus est l’infection fongique opportuniste aéroportée la plus fréquente et celle qui engendre le taux de mortalité le plus élevé {675}. En plus de tirer profit des défenses affaiblies de l’hôte, l’Aspergillus fumigatus produit des substances biochimiques spécifiques possédant des caractéristiques biologiques qui augmentent ses capacités opportunistes. Les principaux facteurs de virulence de ce mycète sont de fait sa capacité à se développer à 37 °C et sa production de toxines cytotoxiques.
Plus de détails
Effectivement, l’A. fumigatus peut bien tolérer des températures situées à la limite supérieure des températures auxquelles survivent les organismes eucaryotes; cette thermotolérance lui confère des propriétés uniques de virulence et lui permet de s’adapter aux paramètres de l’hôte {673}.
Les souches d’A. fumigatus isolées d’échantillons cliniques et de l’environnement élaborent des métabolites qui sont considérés comme étant des facteurs potentiels de virulence : ces facteurs incluent la production de colorants et de molécules d’adhérence sur la surface des cellules ainsi que la sécrétion des enzymes et des toxines hydrolytiques {791, 4138, 4143, 4166, 4189}.
Les mycotoxines présentes dans les souches cliniques peuvent contribuer à la pathogénicité de l’A. fumigatus {299, 4146}, étant donné qu’elles facilitent la pénétration du mycète dans l’épithélium par la lyse cellulaire. D’autres mécanismes reliés aux toxines ont été étudiés, principalement les mécanismes empêchant la phagocytose de la moisissure par les cellules immunes de l’hôte {673, 794, 299, 675}. La pathogénicité de l’A. fumigatus pourrait être favorisée par ses effets toxiques sur les macrophages {4104, 4137, 794, 4193}, les neutrophiles {4108} et les leucocytes {4136}. Il a été démontré que, expérimentalement, le diffusat de spores, isolées à partir de certaines souches d’Aspergillus fumigatus, empêche la phagocytose des mycètes par les macrophages alvéolaires murins {4104, 4137}.
La gliotoxine est probablement la toxine principale déclenchant ces mécanismes. Il a été suggéré que cette toxine pourrait jouer un rôle important dans la pathogenèse de l’aspergillose, car elle possède une activité immunosuppressive tant in vitro qu’in vivo {791}. La gliotoxine de l’Aspergillus fumigatus empêche les neutrophiles humains de phagocyter et de tuer les conidies d’A. fumigatus, ce qui facilite sa dissémination {4108}.
Au cours d’une étude, des isolats d’Aspergillus (n = 103), provenant de patients cancéreux, ont été examinés pour déterminer leur distribution taxonomique et leur capacité à produire de la gliotoxine; la gliotoxine a été détectée dans 93 % des souches d’Aspergillus fumigatus {4146}. Ces résultats suggèrent fortement que cette toxine pourrait jouer un rôle important dans la virulence du mycète.
Milieux particuliers
Infections nosocomiales
Des centaines de rapports de cas uniques et d’éclosions d’infections nosocomiales à A. fumigatus ont été rapportés dans la littérature. Même de petites concentrations de spores ont été associées aux éclosions d’aspergillose, surtout à A. fumigatus ou à A. flavus. Conséquemment, il est reconnu que les patients à risque ne devraient pas être exposés à l’Aspergillus. Des mesures environnementales et des protocoles de prévention des infections doivent être mis en place pour limiter ce risque {434, 1255}.
Les mesures de prévention des infections comprennent notamment les processus de nettoyage et de désinfection des lieux ainsi que la filtration adéquate de l’air; ces mesures doivent aussi inclure des protocoles de surveillance des infections dans les situations à haut risque {492, 4159}. Les unités portatives appropriées de filtration d’air se sont avérées utiles dans certains milieux, et ce, même avec un traitement d’air de courte durée {4103, 622}.
Presque toutes les éclosions d’aspergilloses nosocomiales sont attribuées à des sources aéroportées, et, la plupart du temps, à des travaux de construction {434, 2465}. Afin de limiter ce risque, les travaux de construction en milieu hospitalier devraient être effectués en suivant des mesures strictes de confinement {4285, 691, 434, 1255, 4265}. L’A. fumigatus a été isolé en milieu de soins dans diverses circonstances, que ce soit la contamination par l’Aspergillus des réseaux d’alimentation en eau, des systèmes de ventilation et de filtration d’air ou l’introduction de poussières générées lors de travaux de construction {4100, 4153}.
L’incidence croissante de l’aspergillose nosocomiale envahissante est souvent reliée au développement de nouvelles thérapies combiné à la présence de spores d’Aspergillus dans l’environnement des patients traités. Des travaux d’excavation, de construction, de démolition ou de rénovation, à proximité ou à l’intérieur d’un hôpital, sont indubitablement impliqués dans ce processus. D’autres sources moins courantes telles que les plantes en pot et les sachets de poivre moulu ont été identifiées en tant que sources des spores d’Aspergillus {4156, 435, 434}.
Quelques cas rapportés d’aspergillose sont de type iatrogénique : ces infections ont eu lieu aux sites d’injection ou aux sites d’emplacement de cathéters à demeure ou lors de la dialyse {4119, 4313}.
Les investigations épidémiologiques couplées au typage des souches ont réussi à associer une source environnementale à la survenue de quelques cas isolés ou d’éclosions.
Plus de détails
Il est maintenant bien reconnu que la réalisation de travaux de construction influe sur les taux d’infections nosocomiales à Aspergillus; toutefois, les meilleures mesures de prévention et de confinement restent à définir {691}.
L’aspergillose chez les patients pédiatriques immunocompromis a été associée à la conception et à la salubrité du bâtiment ainsi qu’à la contamination de l’air intérieur {2074}.
Dans un cas, l’aspergillose chez des patients pédiatriques immunocompromis a pu être attribuée à deux défaillances : la défectuosité d’une porte à rebuts permettant à l’air contaminé de passer et la dispersion d’aérosols provenant de l’aspirateur contaminé de l’unité de soins, qui avait les concentrations les plus élevées d’Aspergillus fumigatus de tout l’hôpital (mesures intérieures et extérieures) {2074}.
Un relevé aérobiologique dans une unité de pneumologie d’un hôpital a permis de constater que l’espèce dominante était l’Aspergillus fumigatus; le mycète représentait en moyenne 77,0 % des souches fongiques totales isolées dans l’air de cette unité; les chercheurs ont observé un pic très distinct en novembre et la concentration la plus faible en mai {487}.
Des propagules aéroportées d’Aspergillus ont été trouvées dans les salles de bains (2,95 ufc/m³) où l’utilisation de l’eau était la plus élevée, à des concentrations sensiblement supérieures à celles mesurées dans les chambres des malades (0,78 ufc/m³) ou dans les corridors (0,61 ufc/m³) {351}.
Un suivi temporel des contaminants de l’air a prouvé que quelques souches peuvent persister dans un même environnement pendant au moins six mois. Lors de cette étude, des patients présentant une aspergillose envahissante avaient été infectés par une même souche sur une période de deux ans {56}.
Différentes méthodes de typage des souches se sont avérées efficaces lors d’investigations d’éclosions {4145}. De nombreuses études concernant des éclosions ont pu associer les cas d’une même éclosion soit à une exposition commune, soit à des sources multiples présentes en même temps; parfois, les investigateurs ont pu éliminer seulement certaines sources en tant que causes probables sans qu’ils aient pu identifier la ou les sources réelles de l’éclosion {4128, 2439, 382, 4150, 385, 4186}. Les causes externes et multiples de la contamination du milieu hospitalier peuvent expliquer les nombreuses difficultés rencontrées lors d’investigations épidémiologiques pour associer les souches cliniques à des souches environnementales. {351, 384, 56, 4156}.
Maladies professionnelles
Des problèmes respiratoires ont été associés à l’exposition à l’A. fumigatus en milieu de travail : des réactions allergiques, de l’asthme et des pneumonites d’hypersensibilité (HP) ainsi que des réactions aux toxines ont été rapportés. La plupart des cas sont observés chez des ouvriers exposés à de la matière végétale ou aux eaux usées; ces problèmes surviennent chez des cas uniques ou chez des cas multiples reliés à une même exposition en milieu de travail.
Plus de détails
Les ouvriers les plus à risque sont les suivants :
- fermiers et ouvriers des silos {4093, 1625, 4180, 4179};
- préposés à la manipulation du tabac et des autres végétaux {4125, 3266, 2603};
- éboueurs et trieurs de matières recyclables {226, 4154};
- ouvriers des sites d’enfouissement {1149, 1148, 3957};
- égoutiers et ouvriers des usines de traitement des eaux usées {4113, 4112};
- ouvriers des usines de fabrication de biocarburants, de compostage et de transformation de la mousse de tourbe {4102, 1151, 783, 1150, 4149};
- ouvriers des scieries et des usines de meubles {4099, 776, 4177};
- plâtriers exposés au sparte {208, 246, 1687};
- employés travaillant dans des édifices contaminés {4139}.
Fermiers et ouvriers des silos
L’affection pulmonaire du fermier, ou poumon du fermier, est une maladie allergique très bien connue, une réaction allergique de Type III, autrement dit une pneumonite d’hypersensibilité (HP) médiée par les IgG; cette pneumonite est provoquée par l’inhalation de poussière émanant de foin moisi ou de tout autre type de récolte contaminée (paille, maïs, ensilage, grains, pommes de terre, tabac, herbes).
Les fermiers présentant une réactivité cellulaire aux microbes aéroportés souffrent plus fréquemment des symptômes cutanés professionnels et de la dermatite allergique. Dans le contexte d’une étude, 75 jeunes cultivateurs (49 hommes et 26 femmes âgés de 16 à 23 ans) ont subi un examen dermatologique, laryngologique et pulmonaire, des tests cutanés avec des allergènes courants et ceux provenant de la ferme ainsi que des tests sériques Phadiatop et la mesure totale des IgE. Les épreuves effectuées avec les acariens de stockage et les allergènes fongiques se sont révélées utiles pour déterminer la cause des symptômes de ces jeunes cultivateurs {4180, 4179}.
Les fermiers et les employés de silos sont également exposés aux mycotoxines contenues dans les grains et la poussière du foin. Ces toxines sont plus abondantes dans les produits stockés qui fermentent spontanément d’eux-mêmes. Des chercheurs se sont penchés sur l’exposition du bétail et des ouvriers de ferme aux mycotoxines pendant les derniers mois d’utilisation des ensilages, à la flore fongique et aux mycotoxines présentes dans un ensilage fermenté (11 mois) {1625}. Une méthode permettant d’examiner simultanément plusieurs mycotoxines a été conçue afin d’évaluer in vitro la capacité toxinogène des souches fongiques. Le criblage des mycètes potentiellement toxinogènes, isolés à partir de l’ensilage fermenté, a démontré que l’Aspergillus fumigatus et six espèces de Fusarium pouvaient produire des mycotoxines sur milieu gélosé. Sept mycotoxines principales (aflatoxine B, citrinine, déoxynivalénol, fumonisine B, gliotoxine, ochratoxine A et zéaralénone) ont également été recherchées dans l’ensilage de maïs par la chromatographie liquide à haute résolution couplée à la spectrométrie de masse (HPLC-MS). Parmi les trois mycotoxines (citrinine, gliotoxine et déoxynivalénol) détectées dans l’ensilage, la gliotoxine, une mycotoxine fortement immunosuppressive, était produite dans l’ensilage mûr à des concentrations allant jusqu’à 877 ppb; cette mycotoxine a été associée à la présence de l’A. fumigatus dans l’ensilage.
Préposés à la manipulation du tabac et des autres végétaux
Des études ont démontré que les ouvriers manipulant le tabac, les pommes de terre et les herbes peuvent être exposés à de la matière végétale moisie {3899, 4125, 1108, 3266, 2680, 2603}. La fréquence des réactions allergiques positives aux microorganismes aéroportés est élevée, notamment chez les personnes exposées en milieu de travail à la poussière des herbes; ces résultats suggèrent le rôle potentiel des allergènes microbiens dans la pathogénie des maladies professionnelles chez ces ouvriers {2680, 2603}. Une étude menée auprès d’ouvriers exposés à de la poussière générée lors de la manipulation d’herbes culinaires a démontré que la prévalence des réactions positives aux tests cutanés antimicrobiens était plus élevée chez ce groupe comparativement aux témoins {4125}. Les résultats des épreuves de précipitines ont également montré une plus grande réactivité aux antigènes microbiens environnementaux dans le groupe exposé, comparativement à la fréquence des résultats positifs chez le groupe témoin; de plus, la prévalence des résultats positifs des épreuves de MIF (migration inhibiting factor) pour l’Aspergillus fumigatus était de 13,3 % chez les sujets exposés. L’ensemble des résultats permet aux auteurs de conclure qu’il existe un risque significatif de sensibilisation à l’A. fumigatus chez les préposés à la manipulation des herbes et que ce risque semble être plus élevé parmi les cultivateurs de thym.
Éboueurs et trieurs de matières recyclables
Un nombre de plus en plus important de personnes affectées à la collecte des ordures et à la séparation des matières recyclables seraient exposées à des charges élevées de bactéries et de mycètes présents dans l’air ambiant, et ce, à une concentration représentant un risque pour leur santé. {226}. Un rapport mentionne le cas d’un patient pour qui un diagnostic d’aspergillose bronchopulmonaire allergique (ABPA) a été posé; le tableau clinique comprenait des réponses asthmatiques et une pneumonite d’hypersensibilité (alvéolite allergique extrinsèque) due à l’exposition aux ordures ménagères. La concentration des anticorps de type IgE et de type IgG, dirigés contre l’Aspergillus fumigatus, était fortement élevée; chez ce patient, les anticorps ont persisté au moins deux ans. L’exposition à un extrait d’Aspergillus fumigatus contenant de la gliotoxine a provoqué une réaction asthmatique de type immédiat.
Des études sur le terrain concernant l’exposition microbienne associée à la collecte des ordures ménagères ont démontré que, pendant les périodes chaudes de l’été, la concentration en Aspergillus fumigatus aéroporté augmentait et pouvait atteindre jusqu’à 90 000 ufc/m³ d’air {4154}.
Ouvriers des sites d’enfouissement
Les ouvriers des sites d’enfouissement sanitaire sont exposés aux mêmes bioaérosols que les éboueurs et les trieurs de matières recyclables, voire en plus grandes concentrations. En outre, une étude a suggéré que les souches d’Aspergillus fumigatus se développant dans des déchets stockés produisent des enzymes cellulolytiques puissantes; d’autres études seraient nécessaires afin de qualifier les effets allergènes ou immunotoxiques potentiels de ces protéines sur la santé des ouvriers exposés {3957}.
Égoutiers et ouvriers des usines de traitement des eaux usées
L’Aspergillus fumigatus pathogène peut être trouvé à toutes les étapes du traitement des eaux résiduelles {4112}. Les boues résiduaires sont la source principale d’émission de moisissures dans l’air ambiant des usines de traitement des eaux usées. Étant donné la présence de moisissures possédant des propriétés infectieuses et allergiques reconnues, il est recommandé que les employés utilisent de l’équipement de protection personnelle.
L’évaluation de l’exposition aux bioaérosols des égoutiers a montré également, dans ce milieu de travail, la présence de l’Aspergillus fumigatus, agent classé comme étant un agent biologique nocif associé à la « catégorie 2 des risques professionnels » {4113}.
Il existe des profils spécifiques de mycotoxines produites par certaines espèces fongiques présentes dans les cultures de moisissures isolées à partir des matières résiduelles. Ces toxines sont aussi trouvées dans les conidies aéroportées provenant des mycètes obtenus à partir des matières résiduelles {1148}. Les souches d’Aspergillus fumigatus étudiées ont le potentiel de produire des mycotoxines et des métabolites secondaires non volatils. Certaines des mycotoxines caractéristiques de l’A. fumigatus, telles que la fumigaclavine C, la tryptoquivaline et la trypacidine, ont été décelées dans les extraits des conidies; toutefois, des toxines plus nocives, comme la gliotoxine et les fumitrémorgènes, étaient absentes.
Ouvriers des usines de fabrication de biocarburants, de compostage et de transformation de la mousse de tourbe
L’Aspergillus fumigatus est l’une des espèces les plus fréquemment détectées dans l’air des usines de compostage et des installations de traitement des déchets {4102}. Une gamme de composés organiques volatils microbiens (MCOV) et de métabolites secondaires ainsi que des mycotoxines ont été trouvés dans les cultures pures des souches d’A. fumigatus fraîchement isolées de ces milieux. La tryptoquivaline, un composé possédant des propriétés trémorgènes, et la trypacidine, pour laquelle aucune propriété toxique n’est décrite, ont été découverts dans les bioaérosols d’une usine de compostage {783}.
Une étude menée dans une usine de fabrication de biocarburants a permis d’estimer l’exposition des ouvriers affectés à l’estimation de la teneur en eau des copeaux de bois ainsi que des préposés aux bennes; lorsque ces ouvriers travaillent 30 minutes ou plus par jour, ils sont exposés à une concentration médiane de spores d’A. fumigatus de 6,7 x 104/m³ d’air et à une concentration médiane de spores de mycètes de 7,0 X 105/m³. Conséquemment, cet environnement de travail peut causer des troubles respiratoires chez les personnes y œuvrant {4149}.
L’A. fumigatus est également associé à la mousse de tourbe tant naturelle que transformée; l’exposition respiratoire à la poussière organique produite par les litières de tourbe peut induire des maladies pulmonaires chroniques chez les fermiers et les chevaux {4093}.
Ouvriers des scieries et des usines de meubles
La transformation des produits du bois génère de la poussière organique contenant des moisissures. Des mycètes allergènes (surtout de l’Aspergillus fumigatus et des espèces de Penicillium) sont trouvés dans les scieries et les ateliers d’équarrissage {776}; ils sont les microorganismes dominants dans l’air des usines de fabrication de panneaux d’aggloméré {858}. Les réactions allergiques de type immédiat aux microorganismes (surtout à l’Aspergillus fumigatus) sont communes parmi les ouvriers de l’industrie du meuble lors d’expositions à la poussière de bois {4099}.
Plâtriers exposés au sparte
La stipatose (espartosis en anglais) est un type de pneumonite d’hypersensibilité (HP) qui affecte fréquemment des ouvriers de construction manipulant les fibres de sparte utilisées comme matériel de support dans la composition du plâtre de gypse; elle est provoquée par une exposition aux fibres de sparte contaminées par de l’Aspergillus fumigatus ou par des actinomycètes; cette pneumonite se rencontre surtout chez des plâtriers en Espagne, mais elle a aussi été décrite ailleurs {293, 208, 246, 1687, 200}. L’Aspergillus fumigatus est reconnu comme étant le premier agent causal dans la pneumonite d’hypersensibilité (HP) due à l’exposition au sparte; cependant, d’autres sources antigéniques, y compris d’autres mycètes, et les fibres de sparte semblent également jouer un rôle dans la genèse de cette maladie {208}.
Employés travaillant dans des bâtiments contaminés
Des employés travaillant dans des bâtiments contaminés par des moisissures peuvent également présenter des réactions allergiques à A. fumigatus; dans une étude, la moisissure la plus commune associée à la rhinite professionnelle était l’A. fumigatus {4139}.
Outils de diagnostic
Cultures
La mise en évidence de fragments d’hyphes septés, par l’examen direct des sécrétions provenant des sinus, est révélatrice d’une sinusite fongique, mais elle doit être suivie des cultures appropriées pour confirmer que l’A. fumigatus est un agent étiologique.
Le diagnostic d’infection des plaies profondes peut être confirmé par la mise en évidence microbiologique de l’A. fumigatus, c’est-à-dire par la culture des échantillons des prélèvements chirurgicaux sur des tissus normalement stériles.
Pour ce qui est des cas d’ABPA suspectés, les cultures de prélèvements bronchiques peuvent être négatives; même quand ils sont positifs, ces résultats de cultures ne sont pas suffisants pour confirmer le diagnostic : le diagnostic doit être basé sur les critères du tableau clinique caractéristique d’ABPA et les résultats de laboratoire. L’étiologie spécifique de l’hypersensibilité peut être confirmée par des tests immunodiagnostiques (voir la section Immunodiagnostic).
Histopathologie
La coloration par imprégnation argentique (méthanamine) est la plus utile pour obtenir un bon contraste entre les structures fongiques et les tissus atteints. Dans les biopsies pulmonaires, il est parfois possible de voir des conidiophores, avec leur sporulation caractéristique d’Aspergillus, situés dans la lumière des cavités pulmonaires ou dans les couches cellulaires en surface des cavités.
D’autres types de sections de tissus peuvent révéler des formes d’hyphes septés (3 à 5 microns de diamètre) et parfois même, des faisceaux d’hyphes ramifiés. Dans les cas d’infections des yeux, l’examen des sections permet d’observer des cellules géantes contenant des hyphes septés à côté de cellules polymorphonucléaires et de macrophages.
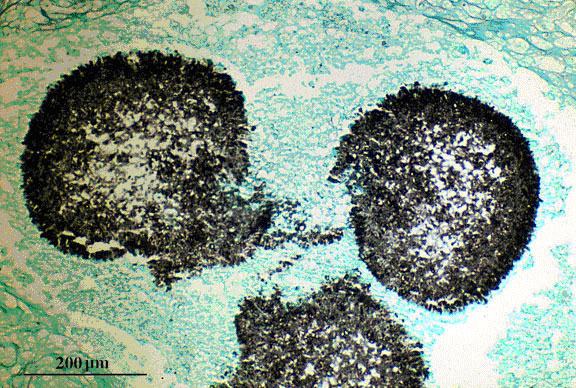
Figure 1. Coloration de Grocott mettant en évidence une masse d’hyphes d’Aspergillus fumigatus (aspergillome).
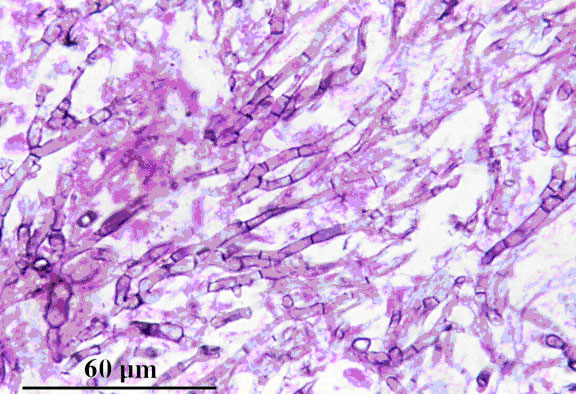
Figure 2. Coloration de Giemsa (GMS) mettant en évidence, dans une coupe de tissu pulmonaire, des hyphes septés d’Aspergillus fumigatus ramifiés de façon dichotomique.
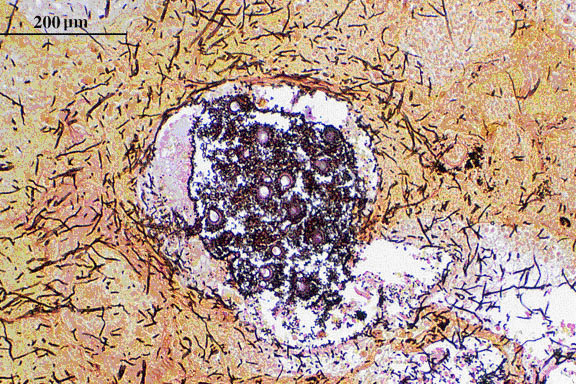
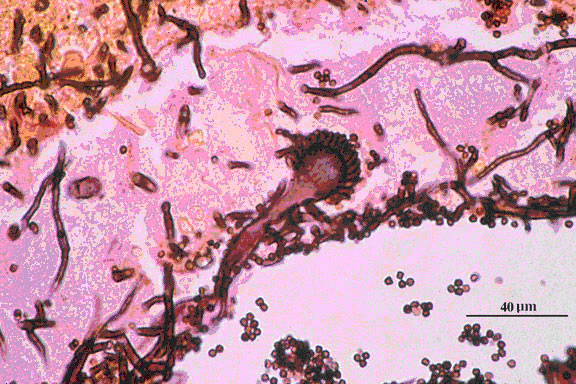
Figure 3. Coloration de Giemsa (GMS) mettant en évidence la présence de têtes de conidies d’Aspergillus fumigatus dans une alvéole.
Immunodiagnostic
Les analyses de sang sont disponibles pour compléter le diagnostic d’une infection, d’une pneumonite d’hypersensibilité (HP) ou d’une réaction allergique à Aspergillus fumigatus. La plupart des épreuves mesurant les anticorps manquent de sensibilité {251}. L’essai d’antigènes de latex est très spécifique, mais il manque également de sensibilité.
Lors d’une étude évaluant les effets sur la santé d’une exposition aux moisissures dans un édifice endommagé par l’eau, une équipe de chercheurs a évalué l’évolution des taux d’anticorps IgG de professeurs travaillant dans une école après la survenue de dégâts d’eau {199}. Les résultats ont indiqué une association entre les épisodes de sinusite rapportés et la présence d’IgG dirigés contre les moisissures; les titres d’IgG étaient sensiblement plus élevés pour ce qui est de dix moisissures, y compris pour l’A. fumigatus.
Les épreuves de précipitines (IgG) d’Ouchterlony sont spécifiques, mais elles ne sont pas aussi sensibles que les épreuves plus récentes du RAST.
Les épreuves cutanées sont couramment disponibles pour diagnostiquer l’allergie à Aspergillus fumigatus. Cependant, les résultats peuvent varier selon le type d’extraits employé pour réaliser l’essai.
Plus de détails
Les extraits allergènes d’Aspergillus fumigatus sont disponibles pour les tests in vitro de RAST et pour le test d’immunodiffusion d’Ouchterlony. Ils sont disponibles sous présentation d’extraits simples ou en mélanges d’allergènes.
Les allergènes de l’Aspergillus fumigatus font partie du programme américain de surveillance de la Federal Drug Administration (FDA) des États-Unis et du Biological Products Deviation Reporting. Non-Blood Product Codes (registre des substances biologiques fongiques recevant les rapports concernant la non-conformité de produits [traduction libre]) {3285}.
GJ08 - Aspergillus amsterdami
GJ09 - Aspergillus clavatus
GJ10 - Aspergillus flavipes
GJ11 - Aspergillus flavus
GJ12 - Aspergillus fumigatus
GJ13 - Aspergillus glaucus
GJ14 - Aspergillus nidulans
GJ15 - Aspergillus niger
GJ16 - Aspergillus ochraceus
GJ17 - Aspergillus restrictus
GJ18 - Aspergillus sydowi
GJ19 - Aspergillus terreus
GJ20 - Aspergillus ustus
GJ21 - Aspergillus versicolor
Liste constituée à partir du registre de l’année 2008 de la Federal Drug Administration (FDA), qui permet de faire le suivi des substances biologiques homologuées, soit le Biological Products Deviation Reporting. Non-Blood Product Codes {3285}.
Épreuves immunodiagnostiques disponibles
| Épreuve | IgE | IgG | Antigènes | Autre |
|---|---|---|---|---|
| Cuti-réactions | X | X | ||
| RAST-IgE | X | |||
| RAST-IgG | X | |||
| ELISA-ELIFA | Expérimental | |||
| Immunodiffusion | Expérimental | |||
| Immunofluorescence | Expérimental | |||
| Fixation du complément | Expérimental | |||
| PCR | ||||
| Autre |
Bibliographie
- 54. Morhart, M., Rennie, R., Ziola, B., Bow, E., and Louie, T. J. (1994). Evaluation of enzyme immunoassay for Candida cytoplasmic antigens in neutropenic cancer patients. J Clin Microbiol. 32[3], 766-776.
- 56. Girardin, H., Sarfati, J., Traore, F., Dupouy, Camet J., Derouin, F., and Latge, J. P. (1994). Molecular epidemiology of nosocomial invasive aspergillosis. J Clin Microbiol. 32[3], 684-690.
- 63. Kern, M E. (1985). Medical mycology a self-instructional text. -239 p. Philadelphia, F. A. Davis Company.
- 142. Bornehag, C. G., Blomquist, G., Gyntelberg, F., Jarvholm, B., Malmberg, P., Nordvall, L., Nielsen, A., Pershagen, G., and Sundell, J. (2001). Dampness in buildings and health. Nordic interdisciplinary review of the scientific evidence on associations between exposure to "dampness" in buildings and health effects (NORDDAMP). Indoor.Air. 11[2], 72-86.
- 154. Verhoeff, A. P. and Burge, H. A. (1997). Health risk assessment of fungi in home environments. Ann Allergy Asthma Immunol. 78[6], 544-554.
- 165. Dales, R. E., Burnett, R., and Zwanenburg, H. (1991). Adverse health effects among adults exposed to home dampness and molds. Am Rev Respir.Dis. 143[3], 505-509.
- 174. Kurup, V. P., Knutsen, A. P., Moss, R. B., and Bansal, N. K. (2006). Specific antibodies to recombinant allergens of Aspergillus fumigatus in cystic fibrosis patients with ABPA. Clin Mol.Allergy. 4:11., 11.
- 176. Shah, A. and Panjabi, C. (2006). Contemporaneous occurrence of allergic bronchopulmonary aspergillosis, allergic Aspergillus sinusitis, and aspergilloma. Ann Allergy Asthma Immunol. 96[6], 874-878.
- 186. Kurup, V. P. (2005). Aspergillus antigens: which are important? Med Mycol. 43 Suppl 1:S189-96., S189-S196.
- 189. Gamboa, P. M., Urbaneja, F., Olaizola, I., Boyra, J. A., Gonzalez, G., Antepara, I., Urrutia, I., Jauregui, I., and Sanz, M. L. (2005). Specific IgG to Thermoactynomices vulgaris, Micropolyspora faeni and Aspergillus fumigatus in building workers exposed to esparto grass (plasterers) and in patients with esparto-induced hypersensitivity pneumonitis. J Investig.Allergol.Clin Immunol. 15[1]
- 199. Patovirta, R. L., Reiman, M., Husman, T., Haverinen, U., Toivola, M., and Nevalainen, A. (2003). Mould specific IgG antibodies connected with sinusitis in teachers of mould damaged school: a two-year follow-up study. Int J Occup.Med Environ Health. 16[3], 221-230.
- 200. Moreno-Ancillo, A., Dominguez-Noche, C., Carmen Gil-Adrados, A., and Cosmes, P. M. (2003). Familial presentation of occupational hypersensitivity pneumonitis caused by aspergillus-contaminated esparto dust. Allergol.Immunopathol.(Madr.). 31[5], 294-296.
- 206. Sarma, U. P., Kurup, V. P., and Madan, T. (2003). Immunodiagnosis of ABPA. Front Biosci. 8:s1187-98., s1187-s1198.
- 208. Cruz, M. J., Morell, F., Roger, A., Munoz, X., and Rodrigo, M. J. (2003). [Hypersensitivity pneumonitis in construction plasterers (espartosis): study of 20 patients]. Med Clin (Barc.). 120[15], 578-583.
- 226. Allmers, H., Huber, H., and Baur, X. (2000). Two year follow-up of a garbage collector with allergic bronchopulmonary aspergillosis (ABPA). Am J Ind.Med. 37[4], 438-442.
- 227. Erkinjuntti-Pekkanen, R., Reiman, M., Kokkarinen, J. I., Tukiainen, H. O., and Terho, E. O. (1999). IgG antibodies, chronic bronchitis, and pulmonary function values in farmer's lung patients and matched controls. Allergy. 54[11], 1181-1187.
- 228. Eppinger, T. M., Greenberger, P. A., White, D. A., Brown, A. E., and Cunningham-Rundles, C. (1999). Sensitization to Aspergillus species in the congenital neutrophil disorders chronic granulomatous disease and hyper-IgE syndrome. J Allergy Clin Immunol. 104[6], 1265-1272.
- 230. Da Broi, U., Orefice, U., Cahalin, C., Bonfreschi, V., and Cason, L. (1999). ARDS after double extrinsic exposure hypersensitivity pneumonitis. Intensive Care Med. 25[7], 755-757.
- 231. Muller-Wening, D., Renck, T., and Neuhauss, M. (1999). [Wood chip alveolitis]. Pneumologie. 53[7], 364-368.
- 233. Skov, M., Pressler, T., Jensen, H. E., Hoiby, N., and Koch, C. (1999). Specific IgG subclass antibody pattern to Aspergillus fumigatus in patients with cystic fibrosis with allergic bronchopulmonary aspergillosis (ABPA). Thorax. 54[1], 44-50.
- 246. Hinojosa, M., Fraj, J., De la, Hoz B., Alcazar, R., and Sueiro, A. (1996). Hypersensitivity pneumonitis in workers exposed to esparto grass (Stipa tenacissima) fibers. J Allergy Clin Immunol. 98[5 Pt 1], 985-991.
- 251. Kappe, R., Schulze-Berge, A., and Sonntag, H. G. (1996). Evaluation of eight antibody tests and one antigen test for the diagnosis of invasive aspergillosis. Mycoses. 39[1-2], 13-23.
- 258. Collins, L. A., Samore, M. H., Roberts, M. S., Luzzati, R., Jenkins, R. L., Lewis, W. D., and Karchmer, A. W. (1994). Risk factors for invasive fungal infections complicating orthotopic liver transplantation. J Infect Dis. 170[3], 644-652.
- 260. Wang, J. M., Denis, M., Fournier, M., and Laviolette, M. (1994). Experimental allergic bronchopulmonary aspergillosis in the mouse: immunological and histological features. Scand J Immunol. 39[1], 19-26.
- 265. Eduard, W., Sandven, P., and Levy, F. (1993). Serum IgG antibodies to mold spores in two Norwegian sawmill populations: relationship to respiratory and other work-related symptoms. Am J Ind.Med. 24[2], 207-222.
- 271. Ojanen, T. (1992). Class specific antibodies in serodiagnosis of farmer's lung. Br J Ind.Med. 49[5], 332-336.
- 273. Corey, J. P. (1992). Allergic fungal sinusitis. Otolaryngol.Clin North Am. 25[1], 225-230.
- 275. Banerjee, B., Joshi, A. P., Sarma, P. U., and Roy, S. (1992). Evaluation of clinico-immunological parameters in pediatric ABPA patients. Indian J Pediatr. 59[1], 109-114.
- 293. (2006). Health concerns associated with mold in water-damaged homes after Hurricanes Katrina and Rita--New Orleans area, Louisiana, October 2005. MMWR Morb.Mortal.Wkly.Rep. %20;55[2], 41-44.
- 299. Kosalec, I. and Pepeljnjak, S. (2005). Mycotoxigenicity of clinical and environmental Aspergillus fumigatus and A. flavus isolates. Acta Pharm. 55[4], 365-375.
- 300. Kosalec, I., Klaric, M. S., and Pepeljnjak, S. (2005). Verruculogen production in airborne and clinical isolates of Aspergillus fumigatus Fres. Acta Pharm. 55[4], 357-364.
- 338. Dimopoulos, G., Piagnerelli, M., Berre, J., Eddafali, B., Salmon, I., and Vincent, J. L. (2003). Disseminated aspergillosis in intensive care unit patients: an autopsy study. J Chemother. 15[1], 71-75.
- 351. Anaissie, E. J., Stratton, S. L., Dignani, M. C., Summerbell, R. C., Rex, J. H., Monson, T. P., Spencer, T., Kasai, M., Francesconi, A., and Walsh, T. J. (2002). Pathogenic Aspergillus species recovered from a hospital water system: a 3-year prospective study. Clin Infect Dis. 34[6], 780-789.
- 354. Grow, W. B., Moreb, J. S., Roque, D., Manion, K., Leather, H., Reddy, V., Khan, S. A., Finiewicz, K. J., Nguyen, H., Clancy, C. J., Mehta, P. S., and Wingard, J. R. (2002). Late onset of invasive aspergillus infection in bone marrow transplant patients at a university hospital. Bone Marrow Transplant. 29[1], 15-19.
- 355. Smedbold, H. T., Ahlen, C., Norback, D., and Hilt, B. (2001). Sign of eye irritation in female hospital workers and the indoor environment. Indoor.Air. 11[4], 223-231.
- 363. Oren, I., Haddad, N., Finkelstein, R., and Rowe, J. M. (2001). Invasive pulmonary aspergillosis in neutropenic patients during hospital construction: before and after chemoprophylaxis and institution of HEPA filters. Am J Hematol. 66[4], 257-262.
- 372. Kontoyiannis, D. P., Wessel, V. C., Bodey, G. P., and Rolston, K. V. (2000). Zygomycosis in the 1990s in a tertiary-care cancer center. Clin Infect Dis. 30[6], 851-856.
- 376. Skov, M., Koch, C., Reimert, C. M., and Poulsen, L. K. (2000). Diagnosis of allergic bronchopulmonary aspergillosis (ABPA) in cystic fibrosis. Allergy. 55[1], 50-58.
- 382. Leenders, A. C., van Belkum, A., Behrendt, M., Luijendijk, A., and Verbrugh, H. A. (1999). Density and molecular epidemiology of Aspergillus in air and relationship to outbreaks of Aspergillus infection. J Clin Microbiol. 37[6], 1752-1757.
- 384. Chazalet, V., Debeaupuis, J. P., Sarfati, J., Lortholary, J., Ribaud, P., Shah, P., Cornet, M., Vu, Thien H., Gluckman, E., Brucker, G., and Latge, J. P. (1998). Molecular typing of environmental and patient isolates of Aspergillus fumigatus from various hospital settings. J Clin Microbiol. 36[6], 1494-1500.
- 385. Radford, S. A., Johnson, E. M., Leeming, J. P., Millar, M. R., Cornish, J. M., Foot, A. B., and Warnock, D. W. (1998). Molecular epidemiological study of Aspergillus fumigatus in a bone marrow transplantation unit by PCR amplification of ribosomal intergenic spacer sequences. J Clin Microbiol. 36[5], 1294-1299.
- 390. Nenoff, P., Horn, L. C., Schwenke, H., Mierzwa, M., Rieske, K., and Haustein, U. F. (1996). [Invasive mold infections in the university clinics of Leipzig in the period from 1992-1994]. Mycoses. 39 Suppl 1:107-12., 107-112.
- 406. Conant, N F, Smith, D T, Baker, R D, and Callaway, J L. (1971). Manual of clinical mycology. 3th edition, -755 p. Philadelphia-London-Toronto, W. B. Saunders Company.
- 413. Storey, E, Dangman, K H, Schenck, P, DeBernardo, R L, Yang, C S, Bracker, A, and Hodgson, M J. (2004). Guidance for clinicians on the recognition and management of health effects related to mold exposure and moisture indoors. -58 p. Farmington, Center for Indoor Environment and Health, University of Connecticut Health Center.
- 415. St-Germain, G and Summerbell, R. (1996). Champignons filamenteux d'intérêt médical. Caractéristiques et idenfication. -314 p. Belmont, Star Publishing Company.
- 434. Santé Canada. (2001). Infections nosocomiales chez les patients d'établissements de santé liées aux travaux de constuction. Atténuer le risque d'aspergillose, de légionellose et d'autres infections. Relevé des maladies transmissibles du Canada 27S2, -46 p. Ministère de la San
- 435. Santé Canada. (1999). Infections nosocomiales liées aux travaux de construction : atténuer le risque d'aspergillose, de légionellose et d'autres infections chez des patients hospitalisés. 6e version, -56 p.
- 487. Augustowska, M. and Dutkiewicz, J. (2006). Variability of airborne microflora in a hospital ward within a period of one year. Ann Agric.Environ Med. 13[1], 99-106.
- 491. Hensley, M. E., Ke, W., Hayden, R. T., Handgretinger, R., and McCullers, J. A. (2004). Levels of total fungus and Aspergillus on a pediatric hematopoietic stem cell transplant unit. J Pediatr.Oncol Nurs. 21[2], 67-78.
- 492. Gangneux, J. P., Poirot, J. L., Morin, O., Derouin, F., Bretagne, S., Datry, A., Kauffmann-Lacroix, C., Paugam, A., Chandenier, J., Bouakline, A., Bordes, M., Chachaty, E., Dupeyron, C., Grawey, I., Lecso, G., Lortholary, J., Mourlhou, P., Nesa, D., Saheb (2002). [Mycologic surveillance of the environment for preventive invasive aspergillosis. Proposals for standardization of the methodologies and implementation]. Presse Med. 31[18], 841-848.
- 512. Newman, M. J. (2002). Neonatal intensive care unit: reservoirs of nosocomial pathogens. West Afr.J Med. 21[4], 310-312.
- 517. Alberti, C., Bouakline, A., Ribaud, P., Lacroix, C., Rousselot, P., Leblanc, T., and Derouin, F. (2001). Relationship between environmental fungal contamination and the incidence of invasive aspergillosis in haematology patients. J Hosp.Infect. 48[3], 198-206.
- 560. Singh, B. P., Banerjee, B., and Kurup, V. P. (2003). Aspergillus antigens associated with allergic bronchopulmonary aspergillosis. Front Biosci. 8:s102-9., s102-s109.
- 566. Norback, D., Walinder, R., Wieslander, G., Smedje, G., Erwall, C., and Venge, P. (2000). Indoor air pollutants in schools: nasal patency and biomarkers in nasal lavage. Allergy. 55[2], 163-170.
- 594. Claeson, A. S., Levin, J. O., Blomquist, G., and Sunesson, A. L. (2002). Volatile metabolites from microorganisms grown on humid building materials and synthetic media. J Environ Monit. 4[5], 667-672.
- 595. Nieminen, S. M., Karki, R., Auriola, S., Toivola, M., Laatsch, H., Laatikainen, R., Hyvarinen, A., and Von Wright, A. (2002). Isolation and identification of Aspergillus fumigatus mycotoxins on growth medium and some building materials. Appl.Environ Microbiol. 68[10], 4871-4875.
- 598. Gao, P., Korley, F., Martin, J., and Chen, B. T. (2002). Determination of unique microbial volatile organic compounds produced by five Aspergillus species commonly found in problem buildings. AIHA.J (Fairfax., Va.). 63[2], 135-140.
- 605. Gravesen, S., Nielsen, P. A., Iversen, R., and Nielsen, K. F. (1999). Microfungal contamination of damp buildings--examples of risk constructions and risk materials. Environ Health Perspect. 107 Suppl 3:505-8., 505-508.
- 622. Sixt, N., Dalle, F., Lafon, I., Aho, S., Couillault, G., Valot, S., Calinon, C., Danaire, V., Vagner, O., Cuisenier, B., Sautour, M., Besancenot, J. P., L'ollivier, C., Caillot, D., and Bonnin, A. (2006). Reduced fungal contamination of the indoor environment with the Plasmairtrade mark system (Airinspace). J Hosp.Infect. .
- 670. Godish, T. J. and Godish, D. R. (2006). Mold infestation of wet spray-applied cellulose insulation. J Air Waste Manag.Assoc. 56[1], 90-95.
- 673. Bhabhra, R. and Askew, D. S. (2005). Thermotolerance and virulence of Aspergillus fumigatus: role of the fungal nucleolus. Med Mycol. 43 Suppl 1:S87-93., S87-S93.
- 675. Latge, J. P. (2003). Aspergillus fumigatis, a saprotrophic pathogenic fungus. Mycologist. 17[Part 2], 56.
- 683. Cornillet, A., Camus, C., Nimubona, S., Gandemer, V., Tattevin, P., Belleguic, C., Chevrier, S., Meunier, C., Lebert, C., Aupee, M., Caulet-Maugendre, S., Faucheux, M., Lelong, B., Leray, E., Guiguen, C., and Gangneux, J. P. (2006). Comparison of epidemiological, clinical, and biological features of invasive aspergillosis in neutropenic and nonneutropenic patients: a 6-year survey. Clin Infect Dis. 43[5], 577-584.
- 684. Singh, N., Limaye, A. P., Forrest, G., Safdar, N., Munoz, P., Pursell, K., Houston, S., Rosso, F., Montoya, J. G., Patton, P. R., Del Busto, R., Aguado, J. M., Wagener, M. M., and Husain, S. (2006). Late-onset invasive aspergillosis in organ transplant recipients in the current era. Med Mycol. 44[5], 445-449.
- 685. Bhatti, Z., Shaukat, A., Almyroudis, N. G., and Segal, B. H. (2006). Review of epidemiology, diagnosis, and treatment of invasive mould infections in allogeneic hematopoietic stem cell transplant recipients. Mycopathologia. 162[1], 1-15.
- 691. Cooper, E. E., O'Reilly, M. A., Guest, D. I., and Dharmage, S. C. (2003). Influence of building construction work on Aspergillus infection in a hospital setting. Infect Control Hosp.Epidemiol. 24[7], 472-476.
- 697. Tabbara, K. F. and al Jabarti, A. L. (1998). Hospital construction-associated outbreak of ocular aspergillosis after cataract surgery. Ophthalmology. 105[3], 522-526.
- 711. Anyanwu, E., Campbell, A. W., and High, W. (2002). Brainstem auditory evoked response in adolescents with acoustic mycotic neuroma due to environmental exposure to toxic molds. Int J Adolesc Med Health. 14[1], 67-76.
- 724. Samson, RA, Hoekstra, ES, and et al. (1984). Introduction to food and airbone fungi. 6th, -389 p. Baarn, Centralalbureau voor Schimmellcultures, Institute of the Royal Netherlands Academy of Arts and Sciences.
- 765. Panaccione, D. G. and Coyle, C. M. (2005). Abundant respirable ergot alkaloids from the common airborne fungus Aspergillus fumigatus. Appl.Environ Microbiol. 71[6], 3106-3111.
- 766. Park, J. H., Cox-Ganser, J., Rao, C., and Kreiss, K. (2006). Fungal and endotoxin measurements in dust associated with respiratory symptoms in a water-damaged office building. Indoor Air. 16[3], 192-203.
- 776. Dutkiewicz, J., Krysinska-Traczyk, E., Prazmo, Z., Skorska, C., and Sitkowska, J. (2001). Exposure to airborne microorganisms in Polish sawmills. Ann Agric Environ Med. 8[1], 71-80.
- 777. Land, C. J., Hult, K., Fuchs, R., Hagelberg, S., and Lundstrom, H. (1987). Tremorgenic mycotoxins from Aspergillus fumigatus as a possible occupational health problem in sawmills. Appl Environ Microbiol. 53[4], 787-790.
- 779. Land, C. J., Lundstrom, H., and Werner, S. (1993). Production of tremorgenic mycotoxins by isolates of Aspergillus fumigatus from sawmills in Sweden. Mycopathologia. 124[2], 87-93.
- 783. Fischer, G., Muller, T., Ostrowski, R., and Dott, W. (1999). Mycotoxins of Aspergillus fumigatus in pure culture and in native bioaerosols from compost facilities. Chemosphere. 38[8], 1745-1755.
- 791. Belkacemi, L., Barton, R. C., Hopwood, V., and Evans, E. G. (1999). Determination of optimum growth conditions for gliotoxin production by Aspergillus fumigatus and development of a novel method for gliotoxin detection. Med Mycol. 37[4], 227-233.
- 794. Kamei, K. and Watanabe, A. (2005). Aspergillus mycotoxins and their effect on the host. Med Mycol. 43 Suppl 1:S95-9., S95-S99.
- 812. Fungal Research Trust. (2007). The Aspergillus Web-Site. http://www.aspergillus.org.uk . 2007.
- 820. Dolen, W. K. (2006). Risk factors for allergic Aspergillus sinusitis. Med Mycol. 44 Suppl:273-5., 273-275.
- 822. Almeida, M. B., Bussamra, M. H., and Rodrigues, J. C. (2006). ABPA diagnosis in cystic fibrosis patients: the clinical utility of IgE specific to recombinant Aspergillus fumigatus allergens. J Pediatr.(Rio J). 82[3], 215-220.
- 846. Jacobs, R. L., Andrews, C. P., and Coalson, J. J. (2005). Hypersensitivity pneumonitis: beyond classic occupational disease-changing concepts of diagnosis and management. Ann Allergy Asthma Immunol. 95[2], 115-128.
- 854. Lugauskas, A., Krikstaponis, A., and Sveistyte, L. (2004). Airborne fungi in industrial environments--potential agents of respiratory diseases. Ann Agric.Environ Med. 11[1], 19-25.
- 858. Dutkiewicz, J., Olenchock, S., Krysinska-Traczyk, E., Skorska, C., Sitkowska, J., and Prazmo, Z. (2001). Exposure to airborne microorganisms in fiberboard and chipboard factories. Ann Agric.Environ Med. 8[2], 191-199.
- 874. Santé Canada. (2007). Protéger la santé des populations vulnérables. Bulletin d'information 5[décembre 2006], 1-2.
- 931. Botterel, F., Cordonnier, C., Barbier, V., Wingerstmann, L., Liance, M., Coste, A., Escudier, E., and Bretagne, S. (2002). Aspergillus fumigatus causes in vitro electrophysiological and morphological modifications in human nasal epithelial cells. Histol.Histopathol. 17[4], 1095-1101.
- 946. Santé Canada. (2007). Ligne directrice sur la qualité de l'air intérieur résidentiel : moisissures. Santé Canada and Ministère de la santé. Gazette du Canada partie 1, 4330-4331. Gouvernenement du Canada. 2-10-0070.
- 979. Cormier, Y., Laviolette, M., Cantin, A., Tremblay, G. M., and Begin, R. (1993). Fibrogenic activities in bronchoalveolar lavage fluid of farmer's lung. Chest. 104[4], 1038-1042.
- 981. Cormier, Y., Fournier, M., and Laviolette, M. (1993). Farmer's fever. Systemic manifestation of farmer's lung without lung involvement. Chest. 103[2], 632-634.
- 989. Centre de recherche sur la conservation des documents graphiques. (2007). Moisissures et biens culturels. Ministère de la culture et de la Communication, France .
- 991. Pitt, J. I. (1989). Recent developments in the study of Penicillium and Aspergillus systematics. J.Appl.Bact.Symp. Suppi. 37S45S.
- 1052. Raper, K. B. and Fennell, D. I. (1965). The Genus Aspergillus. Baltimore, Md, The Williams & Wilkins Co.
- 1089. Bart-Delabesse E and Latgé, JP. (2003). Ecology and genetics diversity of Aspergillus fumigatus. Domer JE & Kobayashi GS (eds). In The Mycota. [XII. Human Fungal Pathogens]. Berlin, Heidelgerg, Springer-Verlag.
- 1090. Ascioglu, S., Rex, JH, de Pauw, B, Bennett, J. E., Bille, J., and Crokaert, F. (2002). Defining opportunistic invasive fungal infections in immunocompromised patients, with cancer and hematopoietic stem cell, transplants: an international consensus. Clin Infect Dis 34, 7-14.
- 1091. Roussel, S., Reboux, G., Dalphin, J. C., Pernet, D., Laplante, J. J., Millon, L., and Piarroux, R. (2005). Farmer's lung disease and microbiological composition of hay: a case-control study. Mycopathologia. 160[4], 273-279.
- 1100. Dangman, K. H., Cole, S. R., Hodgson, M. J., Kuhn, C., Metersky, M. L., Schenck, P., and Storey, E. (2002). The hypersensitivity pneumonitis diagnostic index: use of non-invasive testing to diagnose hypersensitivity pneumonitis in metalworkers. Am J Ind.Med. 42[2], 150-162.
- 1103. Reboux, G., Piarroux, R., Mauny, F., Madroszyk, A., Millon, L., Bardonnet, K., and Dalphin, J. C. (2001). Role of molds in farmer's lung disease in Eastern France. Am J Respir.Crit Care Med. 163[7], 1534-1539.
- 1108. Mackiewicz, B., Skorska, C., Dutkiewicz, J., Michnar, M., Milanowski, J., Prazmo, Z., Krysinska-Traczyk, E., and Cisak, E. (1999). Allergic alveolitis due to herb dust exposure. Ann Agric.Environ Med. 6[2], 167-170.
- 1148. Fischer, G., Muller, T., Schwalbe, R., Ostrowski, R., and Dott, W. (2000). Species-specific profiles of mycotoxins produced in cultures and associated with conidia of airborne fungi derived from biowaste. Int J Hyg.Environ Health. 203[2], 105-116.
- 1149. Fischer, G., Muller, T., Schwalbe, R., Ostrowski, R., and Dott, W. (2000). Exposure to airborne fungi, MVOC and mycotoxins in biowaste-handling facilities. Int J Hyg.Environ Health. 203[2], 97-104.
- 1150. Fischer, G., Muller, T., Ostrowski, R., Schwalbe, R., and Dott, W. (1999). [Mycotoxins as exposure parameters in bioaerosols of composting sites]. Schriftenr.Ver.Wasser Boden Lufthyg. 104:149-62., 149-162.
- 1151. Fischer, G., Schwalbe, R., Moller, M., Ostrowski, R., Hollender, J., and Dott, W. (1998). [Airborne molds and their metabolites at workplaces in composting plants]. Mycoses. 41 Suppl 1:51-5., 51-55.
- 1243. Rutqvist, L. and Persson, P. A. (1966). Studies on Aspergillus fumigatus, experimental mycotoxicosis in mice, chicks and pigs wth the appearance, in pigs, of perirenal edema. Acta Vet.Scand. 7[1], 21-34.
- 1246. Matsuo, T., Nakagawa, H., and Matsuo, N. (1995). Endogenous Aspergillus endophthalmitis associated with periodontitis. Ophthalmologica. 209[2], 109-111.
- 1247. Matsuo, T., Notohara, K., and Yamadori, I. (2005). Aspergillosis causing bilateral optic neuritis and later orbital apex syndrome. Jpn.J Ophthalmol. 49[5], 430-431.
- 1255. U.S.Department of Health and Human Services and Centers for Disease Control and Prevention. (2003). Guidelines for environmental infection control in health-care facilities. Recommendations of CDC and the Healthcare Infection Control Practices Advisory Comittee (HICPAC). -233 p. Atlanta, Centers for Disease Control and Prevention.
- 1287. Knutsen, A. P., Hutcheson, P. S., Slavin, R. G., and Kurup, V. P. (2004). IgE antibody to Aspergillus fumigatus recombinant allergens in cystic fibrosis patients with allergic bronchopulmonary aspergillosis. Allergy. 59[2], 198-203.
- 1399. Koivikko, A., Viander, M., and Lanner, A. (1991). Use of the extended Phadebas RAST panel in the diagnosis of mould allergy in asthmatic children. Allergy. 46[2], 85-91.
- 1420. Immonen, J., Meklin, T., Taskinen, T., Nevalainen, A., and Korppi, M. (2001). Skin-prick test findings in students from moisture- and mould-damaged schools: a 3-year follow-up study. Pediatr Allergy Immunol. 12[2], 87-94.
- 1625. Richard, E., Heutte, N., Sage, L., Pottier, D., Bouchart, V., Lebailly, P., and Garon, D. (2007). Toxigenic fungi and mycotoxins in mature corn silage. Food Chem Toxicol. 45[12], 2420-2425.
- 1687. Moreno-Ancillo, A., Padial, M. A., Lopez-Serrano, M. C., and Granado, S. (1997). Hypersensitivity pneumonitis due to inhalation of fungi-contaminated esparto dust in a plaster worker. Allergy Asthma Proc. 18[6], 355-357.
- 1982. Aleksandrowicz, J. and Smyk, B. (1973). The association of neoplastic diseases and mycotoxins in the environment. Tex.Rep Biol Med. 31[4], 715-726.
- 2019. Malling, H. J., Agrell, B., Croner, S., Dreborg, S., Foucard, T., Kjellman, M., Koivikko, A., Roth, A., and Weeke, B. (1985). Diagnosis and immunotherapy of mould allergy. I. Screening for mould allergy. Allergy. 40[2], 108-114.
- 2074. Anderson, K., Morris, G., Kennedy, H., Croall, J., Michie, J., Richardson, M. D., and Gibson, B. (1996). Aspergillosis in immunocompromised paediatric patients: associations with building hygiene, design, and indoor air. Thorax. 51[3], 256-261.
- 2111. Mori, H., Abe, F., Furukawa, S., Furukawa, S., Sakai, F., Hino, M., and Fujii, T. (2003). FR235222, a fungal metabolite, is a novel immunosuppressant that inhibits mammalian histone deacetylase (HDAC) II. Biological activities in animal models. J Antibiot.(Tokyo). 56[2], 80-86.
- 2123. Walsh, T. J. and Groll, A. H. (1999). Emerging fungal pathogens: evolving challenges to immunocompromised patients for the twenty-first century. Transpl.Infect Dis. 1[4], 247-261.
- 2245. Storms, W. W. (1978). Occupational hypersensitivity lung disease. J Occup Med. 20[12], 823-824.
- 2439. Leenders, A., van, Belkum A., Janssen, S., de, Marie S., Kluytmans, J., Wielenga, J., Lowenberg, B., and Verbrugh, H. (1996). Molecular epidemiology of apparent outbreak of invasive aspergillosis in a hematology ward. J Clin Microbiol. 34[2], 345-351.
- 2465. Vonberg, R. P. and Gastmeier, P. (2006). Nosocomial aspergillosis in outbreak settings. J Hosp Infect. 63[3], 246-254.
- 2481. Anke, H., Kolthoum, I., and Laatsch, H. (1980). Metabolic products of microorganisms. 192. The anthraquinones of the Aspergillus glaucus group. II. Biological activity. Arch Microbiol. 126[3], 231-236.
- 2553. Hueso, Gutierrez P., Jimenez, Alvarez S., Gil-Carcedo, Sanudo E., Gil-Carcedo Garcia, L. M., Ramos, Sanchez C., and Vallejo Valdezate, L. A. (2005). [Presumption diagnosis: otomycosis. A 451 patients study]. Acta Otorrinolaringol.Esp. 56[5], 181-186.
- 2603. Skorska, C., Sitkowska, J., Krysinska-Traczyk, E., Cholewa, G., and Dutkiewicz, J. (2005). Exposure to airborne microorganisms, dust and endotoxin during processing of valerian roots on farms. Ann Agric Environ Med. 12[1], 119-126.
- 2680. Skorska, C., Sitkowska, J., Krysinska-Traczyk, E., Cholewa, G., and Dutkiewicz, J. (2005). Exposure to airborne microorganisms, dust and endotoxin during processing of peppermint and chamomile herbs on farms. Ann Agric Environ Med. 12[2], 281-288.
- 2740. Aira, M. J., Rodriguez-Rajo, F., and Jato, V. (2008). 47 annual records of allergenic fungi spore: predictive models from the NW Iberian Peninsula. Ann Agric Environ Med. 15[1], 91-98.
- 2943. Oh, S. U., Yun, B. S., Lee, S. J., Kim, J. H., and Yoo, I. D. (2002). Atroviridins A-C and neoatroviridins A-D, novel peptaibol antibiotics produced by Trichoderma atroviride F80317. I. Taxonomy, fermentation, isolation and biological activities. J Antibiot.(Tokyo). 55[6], 557-564.
- 3047. Krysinska-Traczyk, E., Skorska, C., Cholewa, G., Sitkowska, J., Milanowski, J., and Dutkiewicz, J. (2002). Exposure to airborne microorganisms in furniture factories. Ann Agric Environ Med. 9[1], 85-90.
- 3266. Mackiewicz, B., Skorska, C., Krysinska-Traczyk, E., Larsson, L., Szponar, B., Milanowski, J., Czekajska-Chehab, E., Sitkowska, J., Cholewa, G., Szymanska, J., and Dutkiewicz, J. (2008). Respiratory disorders in two workers of customs depositories occupationally exposed to mouldy tobacco. Ann.Agric.Environ.Med. 15[2], 317-322.
- 3285. Federal Drug Administration (FDA). (2008). Biological products deviation reporting (BPDR). Non-blood product codes. 3-29-2009.
- 3318. UniProt Consortium. (2009). Taxonomy : fungi metazoa group. Site de UniProt . 4-6-2009.
- 3437. Reijula, K. and Tuomi, T. (2003). Mycotoxins of aspergilli: exposure and health effects. Front.Biosci. 8:s232-5., s232-s235.
- 3561. Ribes, J. A., Vanover-Sams, C. L., and Baker, D. J. (2000). Zygomycetes in human disease. Clin.Microbiol.Rev. 13[2], 236-301.
- 3670. Roussel, S., Reboux, G., Dalphin, J. C., Bardonnet, K., Millon, L., and Piarroux, R. (2004). Microbiological evolution of hay and relapse in patients with farmer's lung. Occup.Environ.Med. 61[1], e3.
- 3729. Flannigan, B., Samson, R. A., and Miller, J. D. (2002). Microorganisms in home and indoor work environments: diversity, health impacts, investigation and control. -504 p. CRC Press.
- 3839. Yman, L. (1992). Molds & Yeasts: Allergen related documents. ImmunoCAP InVitroSight , 1-3. Pharmacia & Upjohn Diagnostics AB, Uppsala, Sweden.
- 3840. Kwong, F. K. and Cook, B. (2002). The complete allergy book. Naperville, Ill, Sourcebooks.
- 3887. Stern, D. A., Morgan, W. J., Halonen, M., Wright, A. L., and Martinez, F. D. (2008). Wheezing and bronchial hyper-responsiveness in early childhood as predictors of newly diagnosed asthma in early adulthood: a longitudinal birth-cohort study. Lancet. 372[9643], 1058-1064.
- 3899. Dutkiewicz, J., Skorska, C., Milanowski, J., Mackiewicz, B., Krysinska-Traczyk, E., Dutkiewicz, E., Matuszyk, A., Sitkowska, J., and Golec, M. (2001). Response of herb processing workers to work-related airborne allergens. Ann.Agric.Environ.Med. 8[2], 275-283.
- 3912. Simon-Nobbe, B., Denk, U., Poll, V., Rid, R., and Breitenbach, M. (2008). The spectrum of fungal allergy. Int.Arch.Allergy.Immunol. 145[1], 58-86.
- 3957. Krikstaponis, A., Lugauskas, A., Krysinska-Traczyk, E., Prazmo, Z., and Dutkiewicz, J. (2001). Enzymatic activities of Aspergillus fumigatus strains isolated from the air at waste landfills. Ann.Agric.Environ.Med. 8[2], 227-234.
- 3971. Robert, V., Stegehuis, G., and Stalpers, J. (2005). The MycoBank engine and related databases. International Mycological Association . International Mycological Association. 9-9-2009.
- 4093. Airaksinen, S., Heiskanen, M. L., Heinonen-Tanski, H., Laitinen, J., Laitinen, S., Linnainmaa, M., and Rautiala, S. (2005). Variety in dustiness and hygiene quality of peat bedding. Ann.Agric.Environ.Med. 12[1], 53-59.
- 4099. Amitani, R., Taylor, G., Elezis, E. N., Llewellyn-Jones, C., Mitchell, J., Kuze, F., Cole, P. J., and Wilson, R. (1995). Purification and characterization of factors produced by Aspergillus fumigatus which affect human ciliated respiratory epithelium. Infect.Immun. 63[9], 3266-3271.
- 4100. Anaissie, E. J., Stratton, S. L., Dignani, M. C., Summerbell, R. C., Rex, J. H., Monson, T. P., Spencer, T., Kasai, M., Francesconi, A., and Walsh, T. J. (2002). Pathogenic Aspergillus species recovered from a hospital water system: a 3-year prospective study. Clin.Infect.Dis. 34[6], 780-789.
- 4102. Beffa, T., Staib, F., Lott, Fischer J., Lyon, P. F., Gumowski, P., Marfenina, O. E., Dunoyer-Geindre, S., Georgen, F., Roch-Susuki, R., Gallaz, L., and Latge, J. P. (1998). Mycological control and surveillance of biological waste and compost. Med Mycol. 36 Suppl 1:137-45., 137-145.
- 4103. Bergeron, V., Reboux, G., Poirot, J. L., and Laudinet, N. (2007). Decreasing airborne contamination levels in high-risk hospital areas using a novel mobile air-treatment unit. Infect.Control.Hosp.Epidemiol. 28[10], 1181-1186.
- 4104. Bertout, S., Badoc, C., Mallie, M., Giaimis, J., and Bastide, J. M. (2002). Spore diffusate isolated from some strains of Aspergillus fumigatus inhibits phagocytosis by murine alveolar macrophages. FEMS.Immunol.Med Microbiol. 33[2], 101-106.
- 4108. Comera, C., Andre, K., Laffitte, J., Collet, X., Galtier, P., and Maridonneau-Parini, I. (2007). Gliotoxin from Aspergillus fumigatus affects phagocytosis and the organization of the actin cytoskeleton by distinct signalling pathways in human neutrophils. Microbes.Infect. 9[1], 47-54.
- 4110. Coyle, C. M., Kenaley, S. C., Rittenour, W. R., and Panaccione, D. G. (2007). Association of ergot alkaloids with conidiation in Aspergillus fumigatus. Mycologia. 99[6], 804-811.
- 4112. Cyprowski, M., Sowiak, M., Soroka, P. M., Buczyrnska, A., Kozajda, A., and Szadkowska-Stanczyk, I. (2008). [Assessment of occupational exposure to fungal aerosols in wastewater treatment plants]. Med Pr. 59[5], 365-371.
- 4113. Cyprowski, M., Buczynska, A., and Szadkowska-Stanczyk, I. (2006). [Exposure assessment to bioaerosols among sewer workers]. Med Pr. 57[6], 525-530.
- 4119. Ewig, S., Paar, W. D., Pakos, E., Schafer, H., Tasci, S., Marklein, G., and Luderitz, B. (1998). [Nosocomial ventilator-associated pneumonias caused by Aspergillus fumigatus in non-immunosuppressed, non-neutropenic patients]. Pneumologie. 52[2], 85-90.
- 4120. Frisvad, J. C., Rank, C., Nielsen, K. F., and Larsen, T. O. (2009). Metabolomics of Aspergillus fumigatus. Med Mycol. 47 Suppl 1:S53-71. Epub;%2008 Sep 1., S53-S71.
- 4125. Golec, M., Skorska, C., Mackiewicz, B., and Dutkiewicz, J. (2004). Immunologic reactivity to work-related airborne allergens in people occupationally exposed to dust from herbs. Ann.Agric.Environ.Med. 11[1], 121-127.
- 4128. Guarro, J., Sole, M., Castany, R., Cano, J., Teixido, A., Pujol, I., Gene, J., Castro, A., and Sarda, P. (2005). Use of random amplified microsatellites to type isolates from an outbreak of nosocomial aspergillosis in a general medical ward. Med Mycol. 43[4], 365-371.
- 4134. Hornef, M. W., Schopohl, J., Zietz, C., Hallfeldt, K. K., Roggenkamp, A., Gartner, R., and Heesemann, J. (2000). Thyrotoxicosis induced by thyroid involvement of disseminated Aspergillus fumigatus infection. J Clin.Microbiol. 38[2], 886-887.
- 4136. Kamei, K., Watanabe, A., Nishimura, K., and Miyaji, M. (2002). [Culture filtrate of Aspergillus fumigatus and its cytotoxic activity against leukocytes]. Nippon.Ishinkin.Gakkai.Zasshi. 43[3], 163-166.
- 4137. Kamei, K., Watanabe, A., Nishimura, K., and Miyaji, M. (2002). Cytotoxicity of Aspergillus fumigatus culture filtrate against macrophages. Nippon.Ishinkin.Gakkai.Zasshi. 43[1], 37-41.
- 4138. Karkowska-Kuleta, J., Rapala-Kozik, M., and Kozik, A. (2009). Fungi pathogenic to humans: molecular bases of virulence of Candida albicans, Cryptococcus neoformans and Aspergillus fumigatus. Acta.Biochim.Pol. 56[2], 211-224.
- 4139. Karvala, K., Nordman, H., Luukkonen, R., Nykyri, E., Lappalainen, S., Hannu, T., and Toskala, E. (2008). Occupational rhinitis in damp and moldy workplaces. Am.J Rhinol. 22[5], 457-462.
- 4140. Khoufache, K., Puel, O., Loiseau, N., Delaforge, M., Rivollet, D., Coste, A., Cordonnier, C., Escudier, E., Botterel, F., and Bretagne, S. (2007). Verruculogen associated with Aspergillus fumigatus hyphae and conidia modifies the electrophysiological properties of human nasal epithelial cells. BMC.Microbiol. 7:5., 5.
- 4143. Kupfahl, C., Michalka, A., Lass-Florl, C., Fischer, G., Haase, G., Ruppert, T., Geginat, G., and Hof, H. (2008). Gliotoxin production by clinical and environmental Aspergillus fumigatus strains. Int.J Med Microbiol. 298[3-4], 319-327.
- 4144. Kurup, V. P., Kumar, A., Kenealy, W. R., and Greenberger, P. A. (1994). Aspergillus ribotoxins react with IgE and IgG antibodies of patients with allergic bronchopulmonary aspergillosis. J Lab.Clin.Med. 123[5], 749-756.
- 4145. Lasker, B. A. (2002). Evaluation of performance of four genotypic methods for studying the genetic epidemiology of Aspergillus fumigatus isolates. J Clin.Microbiol. 40[8], 2886-2892.
- 4146. Lewis, R. E., Wiederhold, N. P., Lionakis, M. S., Prince, R. A., and Kontoyiannis, D. P. (2005). Frequency and species distribution of gliotoxin-producing Aspergillus isolates recovered from patients at a tertiary-care cancer center. J Clin.Microbiol. 43[12], 6120-6122.
- 4149. Madsen, A. M. (2006). Exposure to airborne microbial components in autumn and spring during work at Danish biofuel plants. Ann.Occup.Hyg. 50[8], 821-831.
- 4150. Mellado, E., az-Guerra, T. M., Cuenca-Estrella, M., Buendia, V., Aspa, J., Prieto, E., Villagrasa, J. R., and Rodriguez-Tudela, J. L. (2000). Characterization of a possible nosocomial aspergillosis outbreak. Clin.Microbiol.Infect. 6[10], 543-548.
- 4153. Munoz, P., Guinea, J., Pelaez, T., Duran, C., Blanco, J. L., and Bouza, E. (2004). Nosocomial invasive aspergillosis in a heart transplant patient acquired during a break in the HEPA air filtration system. Transpl.Infect.Dis. 6[1], 50-54.
- 4154. Neumann, H. D. and Balfanz, J. (1999). [Microbial exposure in collection of residential garbage--results of field studies]. Schriftenr.Ver.Wasser.Boden.Lufthyg. 104:533-45., 533-545.
- 4156. Nolard, N. (1996). [Invasive aspergillosis: nosocomial origin of epidemics. Review of the literature]. Bull.Acad.Natl.Med. 180[4], 849-856.
- 4159. Paugam, A., Renaud, B., Bousset, B., Salmon, D., and Dupouy-Camet, J. (1997). [Contribution of air mycological control for the prevention of invasive nosocomial aspergillosis]. Pathol.Biol.(Paris.). 45[5], 410-413.
- 4160. Pepeljnjak, S., Slobodnjak, Z., Segvic, M., Peraica, M., and Pavlovic, M. (2004). The ability of fungal isolates from human lung aspergilloma to produce mycotoxins. Hum.Exp.Toxicol. 23[1], 15-19.
- 4166. Rementeria, A., Lopez-Molina, N., Ludwig, A., Vivanco, A. B., Bikandi, J., Ponton, J., and Garaizar, J. (2005). Genes and molecules involved in Aspergillus fumigatus virulence. Rev.Iberoam.Micol. 22[1], 1-23.
- 4168. Ruiz-Hornillos, F. J., De Barrio, Fernandez M., Molina, P. T., Marcen, I. S., Fernandez, G. D., Sotes, M. R., and de Ocariz, M. L. (2007). Occupational asthma due to esparto hypersensitivity in a building worker. Allergy.Asthma.Proc. 28[5], 571-573.
- 4177. Skorska, C., Krysinska-Traczyk, E., Milanowski, J., Cholewa, G., Sitkowska, J., Gora, A., and Dutkiewicz, J. (2002). Response of furniture factory workers to work-related airborne allergens. Ann.Agric.Environ.Med. 9[1], 91-97.
- 4179. Spiewak, R., Skorska, C., Gora, A., Horoch, A., and Dutkiewicz, J. (2001). Young farmers with cellular reactivity to airborne microbes suffer more frequently from work-related skin symptoms and allergic dermatitis. Ann.Agric.Environ.Med. 8[2], 255-259.
- 4180. Spiewak, R., Gora, A., and Dutkiewicz, J. (2001). Work-related skin symptoms and type I allergy among eastern-Polish farmers growing hops and other crops. Ann.Agric.Environ.Med. 8[1], 51-56.
- 4186. Symoens, F., Viviani, M. A., and Nolard, N. (1993). Typing by immunoblot of Aspergillus fumigatus from nosocomial infections. Mycoses. 36[7-8], 229-237.
- 4189. Tomee, J. F. and Kauffman, H. F. (2000). Putative virulence factors of Aspergillus fumigatus. Clin.Exp.Allergy. 30[4], 476-484.
- 4193. Watanabe, A., Kamei, K., Sekine, T., Waku, M., Nishimura, K., Miyaji, M., and Kuriyama, T. (2003). Immunosuppressive substances in Aspergillus fumigatus culture filtrate. J Infect.Chemother. 9[2], 114-121.
- 4265. Vilavert, L., Nadal, M., Inza, I., Figueras, M. J., and Domingo, J. L. (2009). Baseline levels of bioaerosols and volatile organic compounds around a municipal waste incinerator prior to the construction of a mechanical-biological treatment plant. Waste.Manag. 29[9], 2454-2461.
- 4270. Anaissie, E. J., McGinnis, M. R., and Pfaller, M. A. (2003). Clinical mycology. Anaissie, E. J., McGinnis, M. R., and Pfaller, M. A. -608. Churchill Livingstone.
- 4285. Bartley, J. M. (2000). APIC state-of-the-Art report: the role of infection control during construction in health care facilities. Am.J Infect.Control. 28[2], 156-169.
- 4311. Tell, L. A. (2005). Aspergillosis in mammals and birds: impact on veterinary medicine. Med Mycol. 43 Suppl 1:S71-3., S71-S73.
- 4312. Karim, M., Alam, M., Shah, A. A., Ahmed, R., and Sheikh, H. (1997). Chronic invasive aspergillosis in apparently immunocompetent hosts. Clin.Infect.Dis. 24[4], 723-733.
- 4313. Saigal, G., Donovan Post, M. J., and Kozic, D. (2004). Thoracic intradural Aspergillus abscess formation following epidural steroid injection. AJNR.Am.J Neuroradiol. 25[4], 642-644.
- 4319. d'halewyn, M.-A. (1973). Infections aspergillaires de l'oreille externe et moyenne. Colloque de l'Association canadienne française pour l'avancement des sciences.







