Les IgE totales et spécifiques chez les jeunes Québécois et leurs associations avec les symptômes respiratoires
Les immunoglobulines (ou Ig) sont des protéines présentes dans le sérum sanguin et dans divers liquides biologiques, jouant un rôle essentiel dans la défense de l’organisme contre les agressions. Il existe cinq classes d’immunoglobulines, soit les IgG, IgA, IgM, IgD et IgE. Les IgE constituent le support immunologique de l’hypersensibilité de type 1 (ou immédiate) dont les manifestations apparaissent dans les minutes qui suivent le contact renouvelé avec un allergène sensibilisant. Le terme « allergie » est souvent employé pour qualifier les réactions d’hypersensibilité de type 1, bien que cette dénomination englobe également certains types d’eczéma. Les IgE, qui sont sécrétées contre les allergènes, entraînent la libération d’histamine, substance responsable de l’apparition des symptômes de l’allergie.
L’atopie est une prédisposition héréditaire à produire de manière excessive des IgE, au contact d’allergènes naturellement inhalés ou ingérés en quantité minime, et de développer des manifestations d’hypersensibilité immédiate comme l’asthme, le rhume des foins, etc. L’atopie est reconnue comme un facteur de risque de l’asthme infantile1,2, d’épisodes de sibilances récurrentes3,4 et d’hyperréactivité bronchique5. Elle semble donc jouer un rôle majeur dans l’incidence et la sévérité des symptômes respiratoires chroniques. De plus, un enfant allergique voit son risque de développer de l’asthme augmenter, une exposition continue à l’allergène en cause favorisant la morbidité. Les allergènes les plus fréquemment identifiés en relation avec l’asthme et les autres symptômes respiratoires sont ceux associés aux acariens, aux animaux domestiques (chats et chiens), aux pollens et aux blattes1,4,6-9.
Les IgE sont normalement présentes à des taux variables chez les individus. Les IgE totales (ensemble des IgE circulant dans le sang) et spécifiques (immunoglobulines E reconnaissant spécifiquement un allergène) sont aujourd’hui couramment mesurées dans le sérum pour des fins d’études cliniques et épidémiologiques10. La présence d’IgE spécifiques à un allergène permet le diagnostic d’allergie atopique par rapport à cet allergène. Les études en relation avec les IgE démontrent une grande variabilité entre les populations, que ce soit dans les niveaux d’IgE totales et la prévalence d’atopie aux différents allergènes11, dans l’association IgE totales-IgE spécifiques11-14, dans l’association IgE totales ou spécifiques et symptômes respiratoires3,4,15, ainsi que dans l’association IgE totales ou spécifiques et certaines variables comme le sexe, l’âge, le tabagisme et l’histoire familiale10,13,16,17.
En raison des variations régionales, notamment au regard des conditions climatiques (température et humidité), de la spécificité génétique ou des allergènes locaux, l’étude des IgE totales et spécifiques en relation avec les affections respiratoires chez les jeunes Québécois apparaît pertinente. Dans le but d’évaluer l’importance du problème, nous avons réalisé une étude afin de documenter pour la population d’enfants d’âge primaire et secondaire du Québec :
- les niveaux d’IgE totales et spécifiques;
- l’association entre les IgE sériques et les symptômes respiratoires et,
- les facteurs associés aux variations des IgE (âge, sexe, tabagisme, histoire familiale, variables environnementales).
Matériel et méthodes
La population à l’étude est celle des jeunes Québécois qui ont participé à l’Enquête sociale et de santé auprès des enfants et des adolescents québécois (ESSEAQ) pilotée par Santé-Québec18. Cette enquête a permis de rejoindre 3 665 sujets de 9 ans (n = 1 267), 13 ans (n = 1 186) et 16 ans (n = 1 212). Les participants ont été sélectionnés parmi 189 écoles de l’ensemble du Québec (environ 60 écoles pour chaque groupe d’âge et environ 25 élèves pour chacune d’elles). Parmi ceux-ci, 2 349 ont eu des ponctions veineuses après l’obtention d’une autorisation parentale. La présente étude porte sur ce sous-échantillon.
Les données sur l’asthme et la rhinite allergique ont été documentées par un questionnaire auto-administré aux parents en utilisant les questions de l’ International Study of Asthma and Allergies in Childhood (ISAAC). Le questionnaire de l’ESSEAQ permettait aussi de documenter plusieurs variables susceptibles d’être en lien avec les IgE totales et spécifiques : l’âge, le sexe, le statut socioéconomique (revenu familial), l’histoire familiale d’asthme et de rhume des foins, le tabagisme actif et passif, la présence de chats et de chiens dans le domicile, la promiscuité, l’ethnie, la présence de tapis (dans la pièce principale ou dans la chambre à coucher) et le milieu où est localisée l’école fréquentée (degré d’urbanisation).
Les IgE ont été mesurées par immunoessai pour chacun des participants. Au total, 451 prélèvements sanguins ont fait l’objet d’une analyse pour la détection des IgE contre les allergènes spécifiques. Sur ce nombre, 232 ont été sélectionnés de façon aléatoire parmi les jeunes déclarant avoir au moins un problème respiratoire (sibilance, asthme, rhume des foins, rhinite, rhinoconjonctivite), tandis que 219 autres échantillons ont été sélectionnés de façon aléatoire chez les jeunes ne présentant aucun de ces problèmes. Huit allergènes ont été sélectionnés en fonction de leur corrélation documentée ou présumée avec des problèmes respiratoires en Amérique du Nord, soit les antigènes d’acariens (Dermatophagoides farinae [Df] et Dermatophagoides pteronyssinus [Dp]), de chats, de chiens, de fléole des prés, de moisissures (Alternaria tenuis), de blattes et d’herbe à poux (Ambrosia artemisiifolia).
Résultats
Les valeurs obtenues d’IgE totales variaient de 0 à 7 542 unités internationales par millilitre (UI/ml), la moyenne géométrique étant de 44,4 UI/ml. La concentration moyenne obtenue pour les garçons (51,8 UI/ml) était significativement plus élevée que celle des filles (38,0 UI/ml). Cette différence entre les sexes s’observait de façon significative dans chacune des classes d’âge. Par ailleurs, la moyenne géométrique des IgE totales augmentait significativement avec l’âge (p ≤0,0001).
Seuls deux échantillons se sont avérés positifs pour les allergènes d’Alternaria (moisissure) de même que pour les allergènes de blattes. Des proportions de 20 %, 20 %, 21 % et 18 % des jeunes ayant participé à l’étude étaient respectivement sensibilisés aux allergènes d’acariens Df, d’acariens Dp, de chats et de chiens. En ce qui concerne la prévalence d’atopie pour la fléole des prés et l’herbe à poux, les proportions observées étaient respectivement de 8,1 % et de 7,7 %. Pour l’ensemble de la population étudiée, 41,4 % des jeunes étaient sensibilisés à au moins un des allergènes spécifiques analysés. La proportion de jeunes testés positifs aux allergènes d’acariens (Df et Dp) était significativement plus élevée chez les garçons (p ≤ 0,05). Les analyses ont démontré une augmentation de la prévalence d’atopie aux allergènes d’acariens et d’herbe à poux en fonction de l’âge (p ≤ 0,05) .
Quel que soit l’allergène mesuré, la moyenne géométrique des IgE totales s’est avérée toujours significativement plus élevée chez les jeunes testés positifs à cet allergène (tableau 1). Ces résultats démontrent bien le lien très étroit existant entre les IgE totales et l’atopie chez les enfants et adolescents du Québec. Les analyses ont également démontré une augmentation significative de la concentration moyenne des IgE totales en fonction du nombre d’IgE spécifiques auquel un jeune est sensibilisé.
Tableau 1. Moyenne géométrique des concentrations d’IgE totales chez les jeunes non sensibilités (-) et sensibilisés (+) aux différents allergènes étudiés
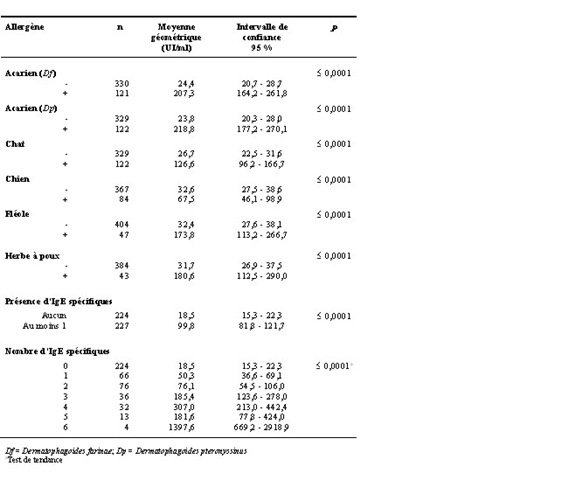
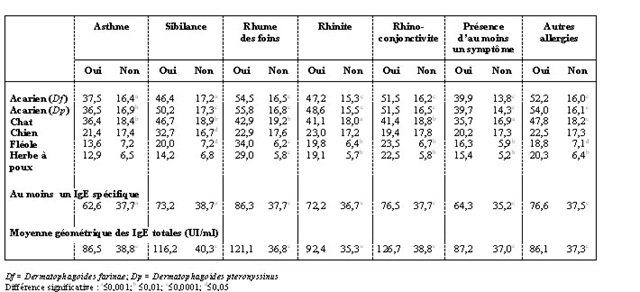
Par ailleurs, les résultats obtenus démontrent que les symptômes respiratoires développés par les jeunes Québécois sont intimement associés aux IgE (tableau 2). En effet, la proportion de jeunes sensibilisés à l’un ou l’autre des allergènes étudiés est toujours plus élevée chez ceux souffrant d’un problème respiratoire. De plus, les concentrations moyennes d’IgE totales sont largement supérieures chez les jeunes souffrant de symptômes respiratoires. Parmi les résultats significatifs, l’asthme et les sibilances sont principalement associés aux allergènes d’acariens et de chats, tout comme le rhume des foins. Pour ce dernier, il existe un lien avec l’atopie aux allergènes de pollen (fléole des prés et herbe à poux).
Tableau 2. Prévalence (%) d’atopie et moyenne géométrique des concentrations d’IgE totales en relation avec les symptômes respiratoires chez les jeunes Québécois de 9, 13 et 16 ans
De façon générale, les jeunes qui ont une histoire familiale d’asthme ou de rhume des foins positive sont plus sujets à développer de l’atopie. Il faut cependant noter que les différences observées entre les proportions sont seulement significatives (p ≤ 0,05) pour les allergènes de fléole en relation avec l’histoire familiale de rhume des foins et pour les allergènes de chats, de chiens et de fléole en relation avec l’histoire familiale d’asthme et de rhume des foins. Par contre, lorsqu’il y a sensibilisation à au moins un allergène, les différences sont toujours significatives. Par ailleurs, les enfants et les adolescents dont l’un des parents souffre ou a déjà souffert d’asthme ou de rhume des foins ont un niveau d’IgE totales significativement plus élevé.
Le degré d’urbanisation de la communauté où se retrouve l’école fréquentée par les participants à l’enquête semble avoir une certaine influence sur l’atopie. En effet, pour les allergènes de chats et de chiens, la proportion de jeunes sensibilisés à ces allergènes était plus élevée (p ≤ 0,05) chez ceux fréquentant des écoles localisées dans les centres urbains d’une population supérieure ou égale à 50 000 habitants, comparativement aux écoles localisées dans des municipalités de moindre importance (< 50 000 habitants). La localisation de l’école n’a toutefois pas eu d’influence significative sur les concentrations moyennes d’IgE totales.
Quel que soit l’allergène considéré, la prévalence d’atopie a tendance à être plus élevée chez les participants d’origine autre que canadienne. Il faut cependant noter que les différences observées ne sont significatives que pour les allergènes d’acariens Df, de fléole et d’herbe à poux. Les analyses ont également démontré que les concentrations moyennes d’IgE totales sont significativement plus élevées chez les jeunes d’origine ethnique autre que canadienne.
Aucune association significative n’a été observée entre les IgE (spécifiques et totales) et les variables suivantes : le revenu familial, le tabagisme (passif ou actif), la présence de chats et de chiens dans le domicile et la promiscuité. Même s’il n’y avait pas de relation entre les IgE spécifiques et la présence de tapis dans le domicile, les concentrations d’IgE totales étaient significativement plus élevées (54,4 UI/ml) chez ceux vivant dans un domicile sans tapis (que ceux-ci aient été retirés ou n’aient jamais été présents) comparativement aux jeunes vivant dans un domicile avec tapis (39,7 UI/ml).
Discussion
Il existe, à travers le monde, une grande variabilité géographique quant aux niveaux sanguins d’IgE totales observés chez les populations d’enfants. Au Danemark, par exemple, les concentrations moyennes calculées chez 508 jeunes (7-16 ans) étaient de 18 UI/ml19 tandis qu’elles étaient de 121 UI/ml chez des garçons et de 98 UI/ml chez des filles de 11 ans de la Nouvelle-Zélande15. Le niveau moyen observé dans l’étude actuelle était de 44,4 UI/ml.
Nous avons observé une différence significative entre les niveaux d’IgE totales des garçons (51,8 UI/ml) et des filles (38,0 UI/ml) ayant participé à notre étude. Une différence entre les sexes a également été remarquée chez une population de jeunes Japonais de 10 à 13 ans12. Toutefois, ni l’étude de Sears et al. ni celle de Backer et al. n’ont révélé de différences entre les garçons et les filles chez les jeunes du Danemark et de la Nouvelle-Zélande, respectivement15,19.
Nos résultats d’analyse sur les IgE spécifiques ont permis d’estimer que 41 % des enfants ayant participé à l’étude étaient sensibilisés à au moins un allergène spécifique (37,7 % chez les non-asthmatiques). Ces résultats sont congruents avec ceux documentés par Laprise et Boulet, qui ont établi à 42 % la prévalence d’atopie (réagissant à au moins un groupe d’allergènes sur six au moyen de tests cutanés) chez 122 personnes non-asthmatiques âgées entre 14 et 70 ans, au Québec20.
La prévalence de jeunes atopiques aux allergènes des deux espèces d’acariens, de chats et de chiens s’est avérée relativement élevée, soit respectivement de 20 % (Df), 20 % (Dp), 21 % et 18 %. Ces proportions semblent, de façon générale, plus élevées que celles mesurées chez d’autres populations d’enfants et d’adolescents21,9. En contrepartie, la prévalence d’atopie à Alternaria (0,4 %) ainsi qu’aux allergènes de blattes (0,7 %) semble très faible chez les jeunes Québécois. Chez les populations vivant dans des milieux défavorisés, l’allergie aux blattes est reconnue comme un facteur de risque important dans le développement de l’asthme et d'autres problèmes de santé7. La faible prévalence d’atopie aux blattes obtenue dans la présente étude pourrait être attribuable au protocole utilisé, qui ne permettait pas de discriminer les populations les plus à risque. De plus, en raison de la localisation plus septentrionale du Québec par rapport à des communautés aux climats plus chauds, les blattes sont peut-être moins abondantes que dans les régions situées plus au sud.
Nos résultats ont démontré une relation évidente entre les concentrations d’IgE totales et l’atopie chez les jeunes Québécois de 9, 13 et 16 ans. Laprise et Boulet avaient également montré une relation similaire chez une population du Québec âgée de 14 à 70 ans20. De leur côté, Backer et al. ont également mis en relief, pour une population de jeunes Danois, que l’atopie déterminée par des tests cutanés était le facteur expliquant le mieux la variation des IgE totales19.
La prévalence des symptômes respiratoires est beaucoup plus élevée chez les jeunes présentant de l’atopie ou ayant un niveau élevé d’IgE totales. Respectivement 63 % et 73 % des asthmatiques et des sujets souffrant de sibilances ont développé des IgE spécifiques à au moins un antigène, en particulier les allergènes d’acariens et de chats. L’association entre les IgE sériques (totales ou spécifiques) et le développement des symptômes respiratoires a été constatée chez plusieurs populations d’enfants3,4,12,15,17,22.
Une relation étroite entre les concentrations d’IgE totales, la prévalence d’atopie et l’histoire familiale d’asthme et de rhume des foins a été documentée chez les jeunes Québécois. Laprise et Boulet avaient également démontré, chez une population adulte du Québec, que les membres d’une famille de sujets asthmatiques avaient une prévalence d’atopie et des niveaux d’IgE sériques plus élevés20.
Dans la présente étude, les enfants fréquentant des écoles localisées en milieu plus urbanisé semblent développer, dans une plus grande proportion, de l’atopie aux allergènes de chats et de chiens. Les études de Bibi et al. et de Crimi et al. ont révélé une plus forte prévalence d’enfants sensibilisés aux allergènes d’animaux domestiques dans les milieux urbains23,24. Chez les populations adultes, il semble également que l’atopie et les symptômes d’allergie soient moins fréquents dans les populations rurales25,26.
Quelques chercheurs affirment qu’une sensibilisation en bas âge à certains allergènes de même qu’aux endotoxines, serait importante dans le développement d’une tolérance face aux allergènes25,27. Cette sensibilisation « protectrice » pourrait être plus importante chez les habitants des milieux moins urbanisés, notamment en ce qui concerne les allergènes d’animaux.
Les jeunes d’origine ethnique autre que canadienne étaient, de façon générale, plus sensibilisés aux différents allergènes et possédaient des niveaux d’IgE totales également plus élevés que les Canadiens d’origine. Chez certaines populations d’enfants asiatiques, le niveau d’IgE sériques considéré normal est souvent très élevé. En effet, une étude réalisée auprès d’écoliers japonais a fixée la limite entre une concentration normale et élevée d’IgE totales à 700 UI/ml12. Ceci vient appuyer le fait qu’il existe des variations importantes d’IgE (totales ou spécifiques) en fonction du pays d’origine, que ce soit en raison de conditions environnementales différentes ou encore de la prédisposition génétique reliée à la race.
Nos résultats n’ont pas démontré d’associations significatives entre les IgE sériques et le revenu familial, le tabagisme, la présence d’animaux (chats et chiens) dans le domicile, la promiscuité et la présence de tapis dans le domicile. L’association réelle entre les IgE et la présence d’animaux et de tapis est difficile à évaluer. En effet, comme les parents des enfants souffrant de symptômes respiratoires ont souvent tendance à éliminer les éléments potentiellement responsables des allergies respiratoires (animaux, tapis), l’interprétation d’une possible association devient plus difficile à vérifier. D’ailleurs, ces comportements préventifs pourraient être à la base du résultat significatif obtenu concernant les IgE totales plus élevées chez les enfants vivant dans un domicile où les tapis ont été enlevés ou qui n’ont jamais eu de tapis.
Cette étude est la première à documenter les variations des IgE sériques chez une population représentative de jeunes Québécois. Elle fournit des données concernant les concentrations d’IgE totales et la prévalence d’atopie pour huit antigènes différents. De plus, les analyses réalisées permettent de mieux comprendre les associations entre les IgE et les affections respiratoires.
L'étude confirme également que l’atopie est un facteur majeur dans le développement de l’asthme chez les enfants et les adolescents du Québec. Les résultats obtenus ont permis de déterminer des données de prévalence, dans une optique de surveillance, quant à la fréquence des diverses allergies chez les jeunes Québécois. Cette étude vient appuyer une approche de contrôle environnemental des allergènes respiratoires dans le traitement de l’asthme et de la rhinite allergique.
Remerciements
Cette étude a été réalisée grâce à une subvention de l’Initiative de recherche Hydro-Québec sur la santé des enfants et l’environnement du Fonds de recherche en santé du Québec.
Références
- Sarpong SB, Karrison T. Skin test reactivity to indoor allergens as a marker of asthma severity in children with asthma. Ann Allergy Asthma Immunol 1998; 80:303-8.
- Miraglia Del Giudice M, Pedulla M, Piacentini GL, Capristo C, Brunese FP, Decimo F, et al. Atopy and house dust mite sensitization as risk factors for asthma in children. Allergy 2002; 57:169-72.
- Sherrill DL, Stein R, Halonen M, Holberg CJ, Wright A, Martinez FD. Total serum IgE and its association with asthma symptoms and allergic sensitization among children. J Allergy Clin Immunol 1999; 104:28-36.
- Ross S, Godden DJ, Abdalla M, McMurray D, Douglas A, Oldman D, et al. Outcome of wheeze in childhood: the influence of atopy. Eur Respir J 1995; 8:2081-7.
- de Marco R. Determinants of bronchial responsiveness in the European Community Respiratory Health Survey in Italy: evidence of an independent role of atopy, total serum IgE levels, and asthma symptoms. Allergy 1998; 53:673-81.
- Platts-Mills TA, Carter MC. Asthma and indoor exposure to allergens. N Engl J Med 1997; 336:1382-4.
- Rosenstreich DL, Eggleston P, Kattan M, Baker D, Slavin RG, Gergen P, et al. The role of cockroach allergy and exposure to cockroach allergen in causing morbidity among inner-city children with asthma. N Engl J Med 1997; 336:1356-63.
- Miles J, Cayton R, Ayres J. Atopic status in patients with brittle and non-brittle asthma: a case-control study. Clin Exp Allergy 1995; 25:1074-82.
- Sears MR, Herbison GP, Holdaway MD, Hewitt CJ, Flannery EM, Silva PA. The relative risks of sensitivity to grass pollen, house dust mite and cat dander in the development of childhood asthma. Clin Exp Allergy 1989; 19:419-24.
- Kerkhof M, Droste JH, de Monchy JG, Schouten JP, Rijcken B. Distribution of total serum IgE and specific IgE to common aeroallergens by sex and age, and their relationship to each other in a random sample of the Dutch general population aged 20-70 years. Dutch ECRHS Group, European Community Respiratory Health Study. Allergy 1996; 51:770-6.
- Burney P, Malmberg E, Chinn S, Jarvis D, Luczynska C, Lai E. The distribution of total and specific serum IgE in the European Community Respiratory Health Survey. J Allergy Clin Immunol 1997; 99:314-22.
- Kagamimori S, Naruse Y, Watanabe M, Nohara S, Okada A. An epidemiological study on total and specific IgE levels in Japanese schoolchildren. Clin Allergy 1982; 12:561-8.
- Omenaas E, Bakke P, Elsayed S, Hanoa R, Gulsvik A. Total and specific serum IgE levels in adults: relationship to sex, age and environmental factors. Clin Exp Allergy 1994; 24:530-9.
- Remes ST, Korppi M. Asthma and atopy in schoolchildren in a defined population. Acta Paediatr 1996; 85:965-70.
- Sears MR, Burrows B, Flannery EM, Herbison GP, Hewitt CJ, Holdaway MD. Relation between airway responsiveness and serum IgE in children with asthma and in apparently normal children. N Engl J Med 1991; 325:1067-71.
- Jarvis D, Luczynska C, Chinn S, Burney P. The association of age, gender and smoking with total IgE and specific IgE. Clin Exp Allergy 1995; 25:1083-91.
- Christie GL, Helms PJ, Godden DJ, Ross SJ, Friend JA, Legge JS, et al. Asthma, wheezy bronchitis, and atopy across two generations. Am J Respir Crit Care Med 1999; 159:125-9.
- ISQ. Enquête sociale et de santé auprès des enfants et adolescents québécois, 1999. Direction Santé Québec, Institut de la statistique, 2002:519.
- Backer V, Ulrik CS, Wendelboe D, Bach-Mortensen N, Hansen KK, Laursen EM, et al. Distribution of serum IgE in children and adolescents aged 7 to 16 years in Copenhagen, in relation to factors of importance. Allergy 1992; 47:484-9.
- Laprise C, Boulet LP. Airway responsiveness and atopy in families of patients with asthma. Clin Invest Med 1996; 19:461-9.
- Hader S, Kuhr J, Urbanek R. Sensitization to 10 important air-borne allergens in school children. Monatsschr Kinderheilkd 1990; 138:66-71.
- Yazicioglu M, Sayinbas P, Ones U, Saltik A, Tugrul M. Alatop: a new in vitro screening test for atopy. J Int Med Res 1994; 22:313-22.
- Bibi H, Shoseyov D, Feigenbaum D, Nir P, Shiachi R, Scharff S, et al. Comparison of positive allergy skin tests among asthmatic children from rural and urban areas living within small geographic area. Ann Allergy Asthma Immunol 2002; 88:416-20.
- Crimi P, Boidi M, Minale P, Tazzer C, Zanrdi S, Ciprandi G. Differences in prevalence of allergic sensitization in urban and rural school children. Ann Allergy Asthma Immunol 1999; 83:252-6.
- Leynaert B, Neukirch C, Jarvis D, Chinn S, Burney P, Neukirch F. Does living on a farm during childhood protect against asthma, allergic rhinitis, and atopy in adulthood? Am J Respir Crit Care Med 2001; 164:1829-34.
- Heinonen OP, Horsmanheimo M, Vohlonen I, Terho EO. Prevalence of allergic symptoms in rural and urban populations. Eur J Respir Dis Suppl 1987; 152:64-9.
- Braun-Fahrlander C, Riedler J, Herz U, Eder W, Waser M, Grize L, et al. Environmental exposure to endotoxin and its relation to asthma in school-age children. N Engl J Med 2002; 347:869-77.
Cet article est une adaptation de « Lévesque B, Duchesne JF, Gingras S, Allard P, Delvin E, Lavallée C, Rhainds M, Lajoie P, Ernst P. Total and specific IgE in Quebec children and adolescents and their relationship to respiratory symptoms. Can Resp J, 2005; 12 : 426-432 ». Nous remercions l’éditeur du Canadian Respiratory Journal, le Dr Nick Anthonisen, de nous permettre de reproduire ici des données déjà publiées.

