La méthodologie d’évaluation du risque toxicologique et la santé des enfants
 Introduction
Introduction
Les impacts potentiels de l’omniprésence de contaminants dans l’environnement sur la santé de la population constituent une préoccupation importante en santé publique. L’évaluation de ces impacts représente un défi de taille pour les intervenants. La méthodologie de l’évaluation du risque toxicologique a été développée à partir des années 1980 en tant qu’outil permettant d’apprécier les impacts de l’exposition aux contaminants de l’environnement sur la santé de la population. Cette méthodologie a été utilisée pour évaluer la sécurité des produits et les impacts de nouveaux projets industriels, pour établir des critères et des normes ou pour valider certains niveaux d’exposition permis par règlements. Par ailleurs, au cours des dernières décennies, les effets de l’exposition des enfants aux contaminants de l’environnement sont devenus une source d’inquiétude majeure. L’intérêt lié à la vulnérabilité particulière des enfants aux agents environnementaux est manifeste dans le rapport du NRC (National Research Council), intitulé Pesticides in the Diet of Infants and Children1, dans lequel on recommande l’élaboration d’une nouvelle approche d’évaluation du risque tenant compte de la spécificité des enfants lors de l’évaluation des impacts potentiels de leur exposition aux contaminants environnementaux. Les enfants ne doivent pas être considérés comme de petits adultes et ce constat doit transparaître dans une approche originale de l’évaluation du risque où l’estimation de l’exposition basée principalement sur les caractéristiques de l’adulte doit évoluer afin de tenir compte de la sensibilité variable selon les différentes étapes du développement1.
Traditionnellement, la méthodologie de l’évaluation du risque comprend les quatre étapes suivantes : l’identification du danger, la définition des relations dose-réponse, l’évaluation de l’exposition et la caractérisation du risque. Ce sont lors des étapes de l’évaluation de l’exposition et de la définition des relations dose-réponse que l’on retrouve les ajustements méthodologiques spécifiques qui prennent en compte la protection de la santé des enfants. En effet, la plus grande susceptibilité des enfants aux contaminants environnementaux par rapport à celle des adultes résulte d’une exposition plus importante attribuable à leurs caractéristiques anthropométriques et physiologiques particulières ainsi qu’à certains comportements caractéristiques. Aussi, à l’étape de la définition des relations dose-réponse, des VTR (valeurs toxicologiques de référence) sont définies pour les différentes substances. Les VTR proviennent d’études réalisées occasionnellement chez l’humain mais, le plus souvent, chez l’animal. Dans les deux cas, elles sont effectuées généralement chez des individus adultes, si bien que les VTR qui en découlent peuvent, dans certaines circonstances, ne pas tenir compte adéquatement de la sensibilité particulière de groupes d’individus. Nous examinerons donc comment la spécificité des enfants est prise en compte lors de ces deux étapes de l’évaluation du risque toxicologique.
L’évaluation de l’exposition
L’évaluation de l’exposition est une étape de la démarche d’évaluation de risque qui vise à calculer les doses auxquelles les personnes sont exposées. Plusieurs paramètres doivent être considérés lors de l’estimation quantitative de l’exposition. Puisque la valeur de ces paramètres est variable en fonction de l’âge, des classes d’âge sont définies afin de permettre une meilleure estimation de l’exposition. Les cinq classes d’âge retenues dans les Lignes directrices (Lignes directrices pour la réalisation des évaluations du risque toxicologique pour la santé humain) du ministère de la Santé et des Services sociaux du Québec (MSSS)2 sont présentées dans le tableau 1.
Tableau 1. Classes d’âge retenues par le MSSS lors de l’évaluation du risque toxicologique à la santé humaine
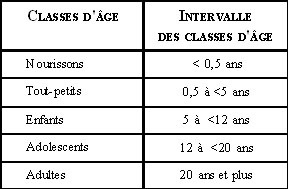
N’étant pas formulée clairement, la définition du terme « enfant » peut varier selon les auteurs. Dans la démarche d’évaluation du risque toxicologique énoncée dans les Lignes directrices2, le terme « enfant », à son sens large, inclut les trois premières classes d’âge (nourrissons, tout-petits et enfants). Les paramètres déterminés pour ces trois classes d’âge le sont en fonction des caractéristiques physiologiques et comportementales des moins de douze ans afin de traduire les différences qualitatives et quantitatives de l’exposition des enfants aux contaminants de l’environnement.
Plusieurs auteurs rapportent qu’en plus d’ingérer plus d’eau et de sol que les adultes et de consommer une plus grande quantité d’aliments qu’eux, les enfants inhalent un volume d’air deux fois supérieur à celui des adultes par rapport à leur poids3, 4, 5.
Le tableau 2 présente les valeurs des différents paramètres des Lignes directrices2, selon la classe d’âge. Ces valeurs sont exprimées en fonction de la masse corporelle. On constate que les paramètres qui concernent les moins de 5 ans sont les plus élevés. Les nourrissons (< 0,5 an) présentent les plus importants taux d’ingestion d’aliments et d’eau potable par rapport à leur poids corporel. Quant aux tout petits (0,5 à < 5 ans), leurs taux d’ingestion de sol et d’inhalation d’air sont supérieurs à ceux des autres classes d’âge. Lorsque l’on compare les taux des adultes avec ceux des enfants, les écarts les plus importants sont observés entre les différents taux d’ingestion de sol et d’aliments ainsi qu’entre les taux d’inhalation d’air.
Tableau 2. Valeurs des paramètres des Lignes directrices2 québécoises pour les différentes classes d’âge lors de l’évaluation de l’exposition aux contaminants
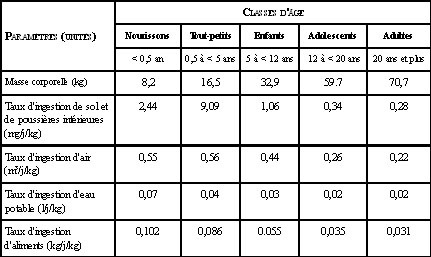
Les enfants ingèrent, en fonction de leur poids corporel, plus d’aliments que les adultes et ils mangent davantage de fruits, de légumes et de produits laitiers4,6. Il existe des différences entre l’alimentation des adultes et celle des enfants qui influencent qualitativement l’exposition des deux groupes aux contaminants présents dans la nourriture7. En plus de disposer d’un menu davantage varié, les adultes ne consomment pas les mêmes aliments que les enfants7. La diversité de l’alimentation limite les chances d’ingérer en grande quantité un aliment qui serait contaminé. La classe d’âge des nourrissons (< 0,5 ans) a la particularité de se nourrir essentiellement de lait de formule ou de lait maternel. Ce dernier peut représenter une source d’exposition à des contaminants ingérés à l’origine par la mère qui s’accumulent dans les tissus adipeux et dans le lait maternel8,9. C’est pourquoi une méthodologie spécifique pour estimer les doses d’exposition attribuables à l’ingestion de lait maternel par les nourrissons a été développée.
En ce qui concerne l’inhalation, les taux exprimés en fonction du poids sont deux fois plus élevés chez les enfants, ce qui se traduit par une exposition par inhalation supérieure chez ces derniers. Cependant, certaines spécificités de l’enfant ne sont pas prises en compte. En effet, de par leur faible taille, les enfants se retrouvent physiquement plus près du sol que les adultes: généralement, les nourrissons et les tout-petits jouent directement sur le sol, sur l’herbe ou sur le plancher. Par ailleurs, la ventilation près du sol a tendance à être faible, laissant présumer que l’air inhalé par les enfants pourrait être de moindre qualité. Habituellement, les échantillons servant à mesurer la qualité de l’air sont prélevés à une hauteur de six pieds au-dessus du sol (hauteur à laquelle les adultes inhalent l’air). Par conséquent, ces mesures ne reflètent pas nécessairement de façon adéquate l’exposition des enfants aux contaminants10.
Les adultes, au même titre que les enfants, peuvent ingérer des poussières intérieures ou encore des particules de sol à la suite d’un contact accidentel des mains avec la bouche. Toutefois, ce type de comportement est beaucoup plus fréquent chez les jeunes enfants comme l’illustrent les valeurs du tableau 2. Ces taux d’ingestion plus élevés de poussières et de sol sont attribuables au fait que les bambins ont tendance à porter souvent les mains et les objets à leur bouche et que leurs activités les mettent en contact avec le sol. Ce type de comportement est communément décrit par le vocable « comportement main bouche ». Il influence à la hausse non seulement l’exposition par ingestion de sol et de poussières, mais aussi les autres sources d’exposition non alimentaires. Ainsi, l’exposition des jeunes enfants aux pesticides utilisés, soit pour usage domestique, soit pour usage agricole, peut être significative, essentiellement en raison de la fréquence élevée à laquelle ils portent les objets ou les mains à la bouche et au fait que leurs activités les mettent en contact direct avec les surfaces traitées ou contaminées11,12,13,14. Les paramètres des Lignes directrices2 ne permettent pas une estimation complète de l’exposition attribuable à ces particularités comportementales des enfants. De ce fait, dans les deux évaluations du risque toxicologique réalisées par l’Institut national de santé publique du Québec (INSPQ) dans le cadre d’un programme de lutte vectorielle contre la transmission du VNO (virus du Nil occidental)15,16, deux sources d’expositions additionnelles ont été considérées pour le groupe d’âge 0,5 à 4 ans : l’ingestion de gazon et l’exposition résultant du « comportement main-bouche ». Ces scénarios particuliers d’exposition ont été élaborés conformément aux procédures décrites par l’OPP (Office of Pesticides Programs)17. À titre de taux de contact main-bouche, la fréquence de 9,5 contacts par heure a été retenue dans l’évaluation du risque de l’INSPQ de 2005 conformément aux taux de contact main-bouche chez les 2 à 6 ans déterminés par les travaux de Reed et al.14. Il en résulte que selon les scénarios d’exposition aiguë et sous chronique élaborés dans cette évaluation, les classes d’âge les plus exposées étaient, dans l’ordre, les tout-petits (0,5 à < 5 ans), les nourrissons (< 0,5 ans), les enfants (5 à < 12 ans), les adolescents (12 à < 20 ans) et les adultes (20 ans et plus). Pour la classe d’âge des 0,5 à < 5 ans, l’ingestion représentait la voie d’exposition la plus importante. En ce qui concerne les nourrissons, les deux principales voies d’exposition étaient l’ingestion et l’absorption cutanée.
À cause de leurs contacts fréquents avec le sol, les enfants sont davantage exposés aux contaminants du sol et aux poussières par la voie cutanée. Le rapport entre la surface corporelle et le poids des enfants, rapport supérieur à celui des adultes, influence également l’exposition par contact cutané18. La charge de sol adhérant à la peau est indirectement fonction de l’âge puisqu’elle dépend des activités pratiquées. Dans un même ordre d’idées, Sedman19 a proposé une équation pour estimer la charge de sol sur la peau en fonction de l’âge. Le taux de contact cutané entre le sol extérieur et la peau suggéré dans les récentes directives de l’EPA20 pour l’estimation de l’exposition par voie cutanée, est de 0,2 mg/cm2 pour les tout-petits et les enfants (0,5 à 12 ans) alors qu’il est de 0,007 mg/cm2 pour les classes d’âge supérieures. Non seulement les enfants sont plus fréquemment en contact avec le sol que les adultes lors d’activités extérieures, mais ils passent aussi deux fois plus de temps à l’extérieur. Les valeurs du temps passé quotidiennement à l’extérieur proposées dans les Lignes directrices2 sont respectivement de 1,4 heure pour les adultes et de 2,8 heures pour les enfants.
L’âge est un facteur déterminant de l’absorption cutanée. En effet, des études ont démontré que le vieillissement de la peau était associé à la diminution de l’hydratation de la couche cornée et que la réduction de la quantité de lipides dans la peau était attribuable à une réduction de l’activité des glandes sébacées, ce qui diminue les capacités d’absorption de la peau21. De plus, dans une étude portant sur l’évaluation du risque à la santé liée à l’exposition aux contaminants du sol, Hawley12 se sert, pour un enfant, d’un taux d’absorption cutanée deux fois plus important que le taux utilisé pour un adulte, soit 12 % de la substance pour une exposition de 12 heures. Un tel élément n’est pas intégré à la version actuelle des Lignes directrices2.
Définition des relations dose-réponse
La définition des relations dose-réponse repose sur les VTR non cancérigènes ou cancérigènes qui sont établies pour chaque substance. Ces valeurs reflètent l’importance de la toxicité de la substance et sont utilisées à l’étape de la caractérisation du risque pour quantifier ce dernier alors qu’elles sont mises en relation avec les doses d’exposition. Or, les VTR sont généralement basées sur des études animales menées chez les individus adultes. L’extrapolation des ces résultats aux enfants peut, dans certaines circonstances, ne pas tenir adéquatement compte des différences entre les enfants et les adultes.
En effet, la physiologie des enfants se distingue de celle des adultes. Les différences entre la physiologie des systèmes cardiorespiratoire (augmentation des taux d’inhalation, du débit cardiaque) et digestif (variation du PH gastrique, de la motilité gastro-intestinale) influencent l’exposition des enfants aux contaminants par rapport à celle des adultes22,23. La présence d’un plus grand pourcentage d’eau dans le corps d’enfant que dans celui de l’adulte et la proportion de liquide extracellulaire, qui diminue avec l’âge, sont tous les deux des éléments qui influencent les volumes de distribution des substances toxiques dans l’organisme. De cette façon, les substances hydrosolubles ont proportionnellement, chez l’enfant, un plus grand volume de distribution et une clairance moins rapide que chez l’adulte. Par contre, le volume de distribution des substances liposolubles chez l’enfant est inférieur à celui de l’adulte avec, pour conséquence, une augmentation de la concentration de la substance dans le sang et une clairance relativement plus rapide22,24. L’immaturité des systèmes de détoxication durant la période prénatale et les premiers mois de vie ainsi que l’absence de certains systèmes enzymatiques entraînent une augmentation de la dose de la substance mère au niveau des organes cibles et l’effet toxique qui en résulte peut être plus ou moins important, dépendamment s’il est attribuable à la substance mère ou à son métabolite25. Les phases de développement et de croissance rapide lors de la période fœtale et de la petite enfance constituent des fenêtres de vulnérabilité favorables à une perturbation de certains systèmes. Les systèmes nerveux central, endocrinien et immunitaire sont particulièrement sensibles à l’exposition aux xénobiotiques lors de ces étapes critiques du développement22,23,25.
À la suite de ces observations, le National Research Council (NRC) recommande que la différence de susceptibilité des individus matures ou immatures soit étudiée systématiquement lors des études de toxicité25. En attendant que cette recommandation soit généralisée, de quelle façon la plus grande susceptibilité des enfants aux substances toxiques est-elle intégrée à la méthodologie de l’évaluation du risque lors de l’étape de la définition des relations dose-réponse?
Dans le cas du risque posé par l’exposition aux substances non cancérigènes, il est apprécié en divisant l’exposition calculée, lors d’un scénario donné, par une VTR spécifique à chaque substance. Si le quotient est supérieur à l’unité, on estime qu’il y a présence de risque puisque l’exposition évaluée est supérieure à l’exposition de référence sans risque illustrée par les VTR. Ces dernières sont établies à partir des NOEL (No Objectival Effect Level) ou des DESE (Doses d’Exposition Sans Effet) obtenus chez l’animal, puis divisées par un facteur de sécurité qui est généralement de 100. Ce facteur est appliqué afin de prendre en compte l’incertitude provenant de l’extrapolation des données de l’animal à l’humain (x 10) et de la variation inter-espèces (x 10). Ce dernier facteur sert à considérer la sensibilité particulière des sous-populations telles que les personnes âgées, les femmes enceintes et les enfants. Il est donc présumé que ce facteur de sécurité assure généralement la protection adéquate des enfants. Cependant, lorsqu’il y a évidence de la présence d’une toxicité développementale ou lorsque les études de toxicité ayant trait aux enfants semblent incomplètes, le comité du NRC recommande qu’un facteur de sécurité supplémentaire de 10 soit appliqué aux VTR25. Cette recommandation du NRC a été intégrée au Food Quality Protection Act des États-Unis afin que les normes ayant trait aux résidus de pesticides dans les aliments soient fixées de telle manière qu’elles soient suffisamment sévères pour protéger la santé des enfants. Dans des documents récents produits par l’OPPTS (Office of Prevention, Pesticides and Toxic Substances) dans le cadre du processus de détermination d’éligibilité de « ré-homologation » des pesticides organophosphorés, un facteur de sécurité supplémentaire de 10 a été ajouté lors de l’élaboration des VTR afin de prendre en compte la toxicité prénatale et postnatale de ces pesticides ou lorsque les données toxicologiques et celles liées à l’exposition sont jugées incomplètes. À titre d’exemple, dans le document d’éligibilité de « ré-homologation » du malathion26, un tel facteur a été appliqué aux doses de référence (Drf) par inhalation et par contact cutané qui ont été utilisées pour estimer les risques attribuables à l’exposition non alimentaire des enfants. L’ajout de ce facteur de sécurité supplémentaire se justifie par le fait que les NOEL ayant servi à la détermination de ces VTR sont issus d’études animales menées exclusivement auprès d’individus adultes. Par contre, étant donné que les NOEL qui ont servi à définir la Drf par ingestion sont déduits d’une étude réalisée chez des chiots et que la susceptibilité des jeunes individus est prise en considération, le facteur supplémentaire n’est pas requis.
Lors de l’évaluation du risque réalisée par l’INSPQ en 2005, les facteurs proposés ci-dessus n’ont pas été appliqués aux VTR retenues. Les différentes Drf utilisées proviennent d’évaluations du risque produites antérieurement à la publication du document d’éligibilité de « ré-homologation » du malathion26.
La caractérisation du risque découlant de l’exposition aux substances cancérigènes est évaluée en multipliant l’exposition journalière moyenne sur toute la durée de la vie par un paramètre appelé « facteur de pente », propre à chaque substance. Ce facteur correspond au nombre théorique de cas de cancers supplémentaires attribuables à l’exposition durant toute la vie à une substance cancérigène par rapport au taux de base observé dans une population non exposée.
Afin de tenir compte de la plus grande susceptibilité des enfants et des adolescents à l’exposition aux substances cancérigènes génotoxiques, l’EPA a émis de nouvelles directives concernant le calcul du risque cancérigène selon lesquelles une importance plus grande est accordée à l’exposition s’étant déroulée durant l’enfance et l’adolescence lors du calcul de la dose journalière moyenne sur toute la durée de la vie27,28,29. Cette plus grande susceptibilité est due à une fréquence plus élevée de divisions cellulaires, à l’absence d’enzymes de réparation de l’ADN au niveau des cellules embryonnaires et à des composantes du système immunitaire non complètement fonctionnelles durant les différentes phases de développement. Lors de cette période, l’exposition à des substances toxiques peut induire des anomalies pouvant prédisposer à des effets cancérigènes plus tard au cours de la vie adulte. D’ailleurs, la comparaison des résultats des études animales, qui tiennent compte de l’exposition périnatale, avec ceux des études animales standards, permet de conclure que les mêmes sites de tumeurs sont observés, que ce soit lors d’une exposition en début de vie ou durant l’âge adulte. De plus, dans les études animales où l’exposition en début de vie et celle de l’adulte ont été prises en compte, on observe une augmentation de l’incidence des tumeurs durant la vie adulte et une diminution de leur période de latence. Ces études indiquent un risque de cancer plus élevé lors d’une exposition aux substances génotoxiques ou mutagènes en début de vie, par rapport à une même exposition durant la vie adulte. Il est donc admis que le risque de cancer attribuable à une exposition en début de vie est plus élevé que celui résultant d’une exposition similaire plus tard dans la vie. L’EPA recommande, dans ses nouvelles directives de mars 200529, que les ajustements supplémentaires suivants soient apportés lorsqu’on évalue le risque de l’exposition aux substances cancérigènes génotoxiques durant toute la vie :
- L’exposition de l’âge de 0 à 2 ans est amplifiée par un facteur d’ajustement de 10.
- L’exposition de l’âge de 2 à 16 ans est amplifiée par un facteur d’ajustement de 3.
À titre d’exemple, le risque cancérigène découlant de l’exposition à une substance génotoxique serait calculé à l’aide de la formule suivante
R = E x[ [P x Fajust. 0-2) x 2] +[P x Fajust. 2-16) x 14] + [(P x 1) x 54] ]
70 70 70
Où :
R = Le risque cancérigène (en nombre de cas additionnels de cancer);
E = Exposition moyenne journalière durant toute la vie (en mg/kg-jour);
P = Facteur de pente (en « cas de cancers additionnels » par mg/kg-jour);
Fajust. 0-2 = Facteur d’ajustement pour une exposition avant l’âge de 2 ans = 10;
Fajust. 2-12) = Facteur d’ajustement pour une exposition de l’âge de 2 à 12 ans = 3.
Conclusion
À l’étape de l’estimation de l’exposition lors de l’évaluation du risque toxicologique, la méthodologie utilisée parvient à traduire les particularités de l’exposition des enfants aux contaminants de l’environnement, soit par l’attribution de valeurs plus élevées aux paramètres relatifs aux classes d’âge des enfants, soit par le recours à des scénarios d’exposition spécifiques qui reflètent leurs comportements particuliers. Ces doses d’exposition ainsi estimées sont plus élevées pour les classes d’âge des enfants, ce qui est en accord avec les observations des auteurs cités dans cet article. Lors de la caractérisation du risque, les doses d’exposition estimées sont mises en relation avec les VTR retenues à l’étape de la définition des relations dose-réponse. Le NRC recommande que les études de toxicité animales servant à la définition ou à la révision des VTR soient réalisées auprès de jeunes individus afin que leur susceptibilité particulière à l’exposition aux contaminants environnementaux soit prise en compte. Par ailleurs, en attendant que cette façon de procéder se généralise, de nouvelles approches ont été proposées pour que cette susceptibilité soit prise en compte à cette étape de l’évaluation du risque. Dans le cas des VTR utilisées pour estimer le risque non cancérigène, l’ajout d’un facteur de sécurité supplémentaire est conseillé lorsqu’il y a évidence de la présence d’une toxicité développementale ou lorsque les études de toxicité relatives aux enfants semblent incomplètes. Cette recommandation du comité du NRC est appliquée par des organismes réglementaires aux États-Unis, entre autres, lors des évaluations de risque réalisées dans le cadre du programme d’éligibilité de « ré-homologation » des pesticides. Il appartient aux professionnels qui effectuent des évaluations de risque de s’assurer que les VTR retenues à cette étape de l’évaluation tiennent compte de la susceptibilité des enfants à l’exposition aux contaminants étudiés et de juger de la pertinence d’appliquer le facteur supplémentaire proposé par le comité du NRC. En ce qui a trait à l’estimation du risque cancérigène, les recommandations récentes de l’EPA, qui consistent à considérer de manière particulière l’exposition aux substances cancérigènes génotoxiques durant l’enfance et l’adolescence, représentent une nouveauté très intéressante dans l’application de cette méthodologie. Des facteurs d’ajustement supplémentaires pour l’exposition durant les deux premières années de vie et pour celles entre l’âge de 2 et 16 ans sont proposés afin de tenir compte de la sensibilité des enfants et de leur réponse toxique particulière à ces substances. De plus, des résultats concluants observés dans des études animales appuient la pertinence de recourir à ces facteurs d’ajustement lors de la démarche de l’évaluation du risque cancérigène. Bien entendu, ces approches comportent leur lot d’incertitudes et, pour cette raison, ne sont pas encore universellement reconnues et demeurent à l’occasion critiquées. Toutefois, leur application témoignerait d’un souci de protection de la santé des enfants dans une situation d’incertitude et donc de l’application d’un principe de prudence. Il sera intéressant d’observer comment les organismes réglementaires appliqueront cette méthodologie et quel sera son impact sur les nouvelles normes ou les nouveaux critères qui en découleront. Enfin, il paraît pertinent que la prochaine version des Lignes directrices2 portant sur l’évaluation du risque toxicologique au Québec (actuellement en cours de révision) fasse preuve d’ouverture à cette approche méthodologique.
Références
- Preston RJ. (2004). Children as a sensitive subpopulation for the risk assessment process. Toxicol Appl Pharmacol.;199(2):132-41.
- Ministère de la Santé et des Services sociaux du Québec (MSSS) (2002). Ligne directrices pour la réalisation des évaluations du risque toxicologique pour la santé humaine, Québec : Gouvernement du Québec; 2002. 83 p. + annexes.
- Roberts RJ.(1992). Overview of similarities and differences between children and adults: implications for risk assessment. Dans : Guzelian PS, Henry CJ, Olin SS, rédacteurs. Similarities and Differences between Children and Adults. Washington, DC: ILSI Press; p. 11-15.
- National Research Council (NRC) (1993). Pesticides in the diets of infants and children. Washington, DC: National Academy Press.
- Biller, JA, Yeager, AM. (1981). The Harriet Lane handbook. 9e ed. Chicago: Year Book Medical Publishers.
- Moya, J., Bearer C.F., Etzel, R.A. (2004). Children’s behavior and physiology and how it affects exposure to environmental contaminants. Pediatrics. 113(4 Suppl):996-1006.
- U.S. Department of Agriculture (USDA) (1985). Nationwide food consumption survey: continuing survey of food intakes by individuals, women 19–50 years and their children 1–5 years. Washington, DC: Human Nutrition Information Service; 1985.
- Sonawane BR. (1995). Chemical contaminants in human milk: an overview. Environ Health Perspect 103 Suppl 6:197-205.
- Hooper K, McDonald TA. (2002). The PBDEs: An emerging environmental challenge and another reason for breast-milk monitoring programs. Environ Health Perspect. 108 (5):
387 92. - Bearer CG. (1995). Environmental health hazard: how children are different from adults. The Future of Children; 5(2):11-26 [consulté le 12 janvier 2007].Disponible: URL: www.futureofchildren.org/usr_doc/vol5no2ART2.pdf
- Carroquino MJ, Galson SK, Licht J, Amler RW, Perera FP, Claxton LD, et al. (1998). The U.S. EPA conference on preventable causes of cancer in children: a research agenda. Environ Health Perspect 106 Suppl 3:867-73.
- Hawley, JK, (1985). Assessment of health risk from exposure to contaminated soil, Risk Anal 5(4):289-302.
- Reed KJ. (2004). Quantification of children’s hand and mouthing activities through a videotaping methodology [thèse]. Rutgers: The State University of New Jersey; 1997.Cité dans : Santé Canada. Partie B, Chapitre 9 : Évaluation de l’exposition par ingestion non alimentaire. Dans : Santé Canada. Lignes directrices sur l’évaluation de l’exposition aux produits antiparasitaires après application (PRO98-04) [monographie sur Internet]. Ottawa : Santé Canada [consulté le 10 janvier 2007]. Disponible : URL : www.pmra-arla.gc.ca/francais/pdf/pro/pro98-04/ChapterB09-f.pdf.
- Reed KJ, Jimenez M, Freeman NC, Lioy PJ. (1999). Quantification of children’s hand and mouthing activities through a videotaping methodology. J Expo Anal Environ Epidemiol 9(5):513-20.
- Institut national de santé publique du Québec (INSPQ). (2002). Évaluation des risques toxicologiques associés à l’utilisation d’adulticides dans le cadre d’un programme de lutte vectorielle contre la transmission du virus du Nil occidental. Montréal : Gouvernement du Québec; 2002.
- Institut national de santé publique du Québec (INSPQ) (2005). Évaluation du risque toxicologique associé à l’utilisation d’adulticides dans le cadre d’un programme de lutte vectorielle contre le virus du Nil occidental (VNO) – Mise à jour de nouvelles données et approche raffinée d’évaluation. Montréal : Gouvernement du Québec; 2005.
- Office of Pesticides Programs (OPP) (1997). Draft : standard operating procedures (SOPs) for residential exposure assessment. health effects division, Versar inc.
- Faustman EM, Silbernagel SM, Fenske RA, Burbacher TM, Ponce RA. (2000). Mechanisms Underlying children’s susceptibility to environmental toxicants. Environ Health Perspect 108 Suppl 1:13-21.
- Sedman RM. (1989). The development of applied action levels for soil contact: a scenario for the exposure of humans to soil in a residential setting. Environ Health Perspect 79:291-313.
- World Health Organization (WHO) (2005). Environmental health criteria document on dermal absorption. Genève (Suisse): International Program on Chemical Safety, World Health Organization.
- Miller DM, Marty MA, Arcus A, Brown J, Morry D, Sandy M. (2002). Differences between children and adults: implications for risk assessment at California EPA. Int J Toxicol; 21:403-18.
- Landrigan PJ. (1999). Risk assessment for children and other sensitive population. Ann N Y Acad Sci; 895:1-9.
- Daston G, Faustman E, Ginsberg G, Fenner-Crisp P, Olin S, Babasaheb S, et al. (2004). A framework for assessing risks to children from exposure to environmental agents. Environ Health Perspect;112(2):
238-56. - Landrigan PJ, Kimmel CA, Correa A, Eskenazi B. (2004). Children’s health and the environment: public health issues and challenges for risk assessment. Environ Health Perspect;112(2):257-65.
- United States Environmental Protection Agency (U.S. EPA) (2006). Office of prevention, pesticides and toxic substances. registration eligibility decision (RED) for Malathion.
- Barton HA, Cogliano VJ, Flowers L, Valcovic L, Woodrow Setzer R., Woodruff TJ. (2005). Assessing, Susceptibility from Ear-Life Exposure to Carcinogens. Environ Health Perspect;113(9):1125-33.
- Hattis D, Goble R, Chu M. (2005). Age-related differences in susceptibility to carcinogenesis. II. Approches for application and uncertainty analyses for individual genetically acting carcinogens. Environ Health Perspect; 113(4):509-16.
- United States Environmental Protection Agency (U.S. EPA) (2005). Supplemental guidance for assessing susceptibility from early-live exposure to carcinogens [monographie sur Internet]. United States Environmental Protection Agency; EPA/630/R-03/003F [consulté le 20 décembre 2006].
- United States Environmental Protection Agency (U.S. EPA). 2004. Risk Assessment Guidance for Superfund Volume I: Human Health Evaluation Manual (Part E, Supplemental Guidance for Dermal Risk Assessment), report No EPA/540/R/99/005, Office of Superfund Remediation and Technology Innovation U.S. Environmental Protection Agency Washington, DC

