Introduction
Introduction
Les Inuits du Nunavik sont exposés aux métaux et aux polluants organiques persistants (POPs) transportés du sud au nord par les courants marins et atmosphériques, et bioamplifiés dans les chaînes alimentaires de l’Arctique. Comme leur régime alimentaire traditionnel comporte d’importantes quantités de mammifères marins, de poissons et de gibier, les Inuits sont davantage exposés à ces contaminants que les populations vivant dans les régions du sud du Québec.
Le mercure et le plomb affectent surtout le système nerveux et peuvent causer des déficiences intellectuelles, comportementales et motrices chez les enfants et les adultes1-9. Le principal risque pour la santé associé au cadmium est la toxicité rénale, tandis que l’exposition chronique peut aussi causer l’anémie, la perte osseuse et des maladies cardiovasculaires10. La présente étude a été menée dans le cadre de l’Enquête de santé auprès des Inuits du Nunavik en 2004 qui avait pour objectifs d’examiner les changements relativement à l’exposition des Inuits aux contaminants environnementaux en mettant à jour l’évaluation du degré d’exposition et de commencer à mesurer les contaminants environnementaux émergents.
Méthodologie de l’enquête
Tous les individus âgés de 15 ans et plus appartenant à la même maisonnée étaient invités à rencontrer l’équipe de recherche sur le navire de la Garde côtière canadienne afin de répondre à un questionnaire individuel ainsi qu’à un questionnaire autoadministré. Les participants âgés de 18 à 74 ans complétaient également un questionnaire de fréquence alimentaire et un rappel alimentaire de 24 heures, puis participaient à une session clinique. Le questionnaire individuel avait comme objectif de recueillir des informations générales sur la santé telle que la perception de la santé, la santé des femmes, les habitudes de vie et le soutien social. Un prélèvement sanguin était effectué afin de mesurer divers paramètres, dont les métaux.
Échantillon et participation à l’enquête
Un échantillon aléatoire stratifié des ménages a été utilisé comme base d’enquête, la communauté ayant été la seule variable de stratification utilisée. Celle-ci a permis une représentation standardisée de la population visée. Parmi les 677 ménages visités par les interviewers, 521 ont accepté de participer (taux de réponse de 77,8 %). Un total de 1 056 personnes ont signé le formulaire de consentement et ont répondu à au moins un questionnaire ou complété un test. Parmi eux, 1 006 individus ont répondu au questionnaire individuel, 925 ont participé à la session clinique, 778 ont répondu au questionnaire de fréquence alimentaire et 664 au rappel alimentaire de 24 heures.
Méthodes de laboratoire
Les analyses de laboratoire ont été effectuées par le Centre de toxicologie de l’Institut national de santé publique du Québec. En 1992, les concentrations de mercure ont été déterminées par spectrométrie d’absorption atomique en vapeur froide (limite de détection de 1 nmol/l). Le plomb et le cadmium étaient mesurés par spectrométrie d’absorption atomique (limite de détection 0,05 µmol/l pour le plomb et 0,2 µg/l pour le cadmium). En 2004, les concentrations des trois métaux ont été mesurées par ICP-MS et les limites de détection étaient respectivement pour le mercure, le plomb et le cadmium de 0,5 nmol/l, 0,001µmol/l et 0,4 nmol/l.
Questionnaire alimentaire
L’alimentation et l’apport en nutriments ont été estimés à partir d’un questionnaire de fréquence de divers aliments et d’un rappel alimentaire de 24 heures. Il visait la mesure de la consommation de nourriture traditionnelle locale (issue de la chasse et de la pêche) pour les quatre saisons précédant l’enquête.
Analyses statistiques
Des analyses statistiques descriptives ont été effectuées à partir des concentrations plasmatiques sanguines de métaux. Des analyses de variance des concentrations sanguines ont été réalisées selon le sexe, les groupes d’âge, l’ethnicité, la région de résidence (Baie d’Hudson, Baie d’Ungava), la consommation de tabac, la consommation de mammifères marins, de poissons, de caribou et de sauvagine. Des analyses comparatives ont été réalisées au seuil a = 0,05. Certaines comparaisons ont pu être réalisées avec les données de 1992.
Résultats
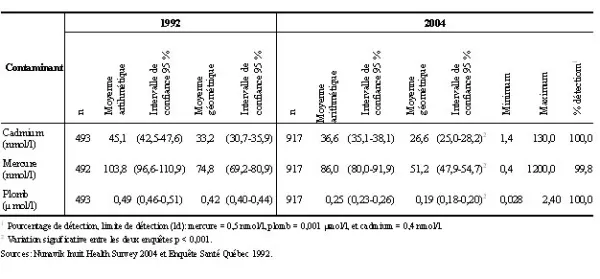
Les résultats obtenus montrent une diminution statistiquement significative des concentrations sanguines de cadmium, de mercure et de plomb entre 1992 et 2004 (tableau 1). Les concentrations sanguines de plomb ont diminué de moitié sur une période de 12 ans. Par contre, 36 %, 9 % et 28 % des individus avaient des concentrations dépassant les niveaux acceptables par Santé Canada pour le cadmium, le plomb et le mercure (données non présentées). Le même phénomène est observé chez les femmes en âge de procréer puisque 35 %, 2 % et 72 % de ces femmes avaient des concentrations sanguines de cadmium, de plomb et de mercure supérieures aux concentrations sanguines recommandées par Santé Canada (données non présentées).
Tableau 1. Concentrations sanguines moyennes pour les métaux, population âgée de 18 à 74 ans, Nunavik, 1992 et 2004
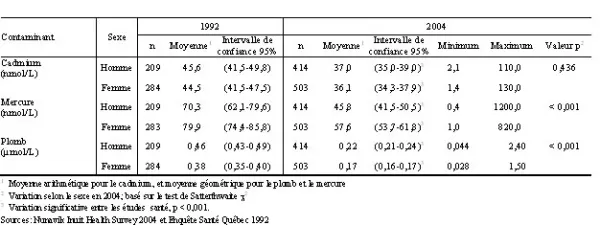
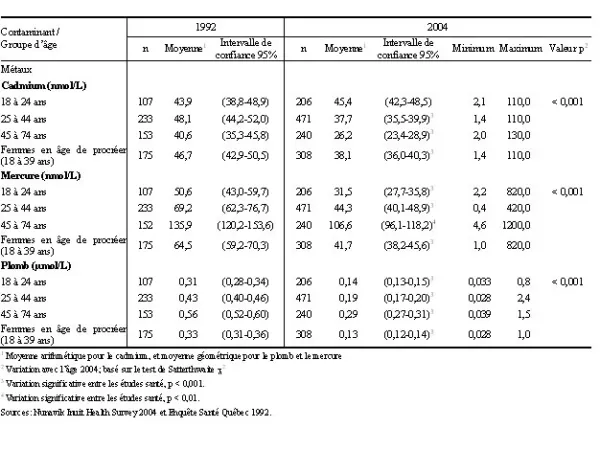
On observe de plus une diminution statistiquement significative de la moyenne des concentrations sanguines de plomb et de mercure selon le sexe et l’âge (tableau 2). En 2004, les concentrations moyennes de mercure étaient statistiquement plus élevées chez les femmes que chez les hommes alors que les concentrations sanguines de plomb étaient plus élevées chez les hommes que chez les femmes. Il n’y a pas de différence significative dans les concentrations de cadmium selon le sexe. Quant aux concentrations moyennes de métaux, elles ont toutes diminué pour tous les groupes d’âge entre 1992 et 2004 sauf pour le cadmium, dont les concentrations chez les adultes âgés de 18 à 24 ans ont augmenté (tableau 3).
Tableau 2. Concentrations sanguines moyennes de cadmium, de mercure et de plomb selon le sexe, chez la population âgée de 18 à 74 ans, Nunavik 1992 et 2004
Tableau 3. Concentrations sanguines moyennes de cadmium, de mercure et de plomb selon le groupe d’âge, chez la population âgée de 18 à 74 ans, Nunavik 1992 et 2004
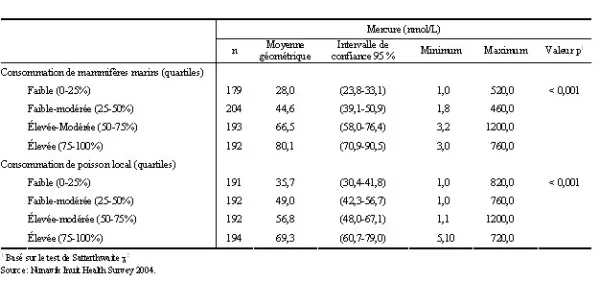
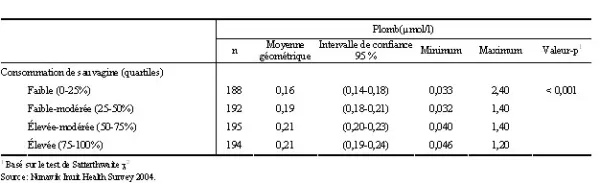
Les associations potentielles entre les concentrations sanguines de métaux et la consommation d’aliments traditionnels et provenant de la chasse ont été examinées. On observe que la concentration sanguine de mercure augmente avec les quartiles de consommation annuelle de mammifères marins et de poissons (tableau 4). De la même façon, une augmentation des concentrations sanguines de plomb est observée avec la consommation annuelle de sauvagine mesurée en quartiles (tableau 5) et de la fréquence de la pratique de la chasse (données non présentées).
Tableau 4. Concentrations sanguines moyennes de mercure selon le quartile de consommation de mammifères marins et de poissons locaux pour la population âgée de 18 à 74 ans, Nunavik, 2004
Tableau 5. Concentrations sanguines moyennes de plomb selon le quartile de consommation de sauvagine (gr/jr, an), pour la population âgée de 18 à 74 ans, Nunavik, 2004
Discussion
En 2004, les concentrations moyennes de mercure demeurent plus élevées (86,0 nmol/l)que celles observées dans une population de référence du Québec (0,1-16 nmol/l11), mais sous le seuil de concentration considérée comme acceptable (99,7 nmol/l chez l’adulte) par Santé Canada12. Néanmoins, le maximum observé dans cette enquête est de 1 200 nmol/l. De plus, 28 % des individus de la population générale et 72 % des femmes en âge de procréer ont des concentrations supérieures aux niveaux recommandés. On observe une concentration moyenne supérieure chez les femmes par rapport aux hommes. Cette différence entre les hommes et les femmes a été rapportée dans d’autres études, mais les résultats, qui différent d’une étude à l’autre, ne permettent pas de conclure sur cet aspect13-15. Par ailleurs, les différences de concentration de mercure selon le groupe d’âge (45-74 ans par rapport aux groupes plus jeunes) pourraient être reliées à des modes d’alimentation différents entre les générations. Comme démontré dans plusieurs études, les concentrations de mercure ont tendance à augmenter en fonction du quartile de consommation de mammifères marins13,16-18 et de poissons17-19.Globalement, les concentrations sanguines de mercure ont diminué de 30 % par rapport aux concentrations mesurées en 199220, baisse qui pourrait être attribuable aux changements alimentaires. Ces changements pourraient être liés aux campagnes de sensibilisation visant la promotion d’aliments traditionnels moins contaminés ou encore par une diminution de la consommation d’aliments traditionnels, remplacés par les aliments venant du Sud.
Les résultats obtenus concernant les concentrations sanguines de plomb se situent à l’intérieur des valeurs de référence pour une population générale du Québec (0,04-0,32 µmol/l)11. De plus, la concentration moyenne observée est plus faible que celle recommandée par Santé Canada21-22, fixée à 0,48 µmol/l. Près de 10 % des individus et 2 % des femmes en âge de procréer sont au-dessus de ce niveau, avec un maximum observé de 2,4 nmol/l. La concentration moyenne observée chez les hommes âgés de 45 à 74 ans est la plus élevée telle que rapportée dans d’autres études13,16,23-25. Les concentrations augmentent par ailleurs en fonction du quartile de consommation de sauvagine et des habitudes de chasse, ce qui est cohérent avec la littérature scientifique13,2326,27. Par rapport aux résultats obtenus en 1992, on observe en 2004 une diminution de 50 % des concentrations sanguines de plomb. Cette diminution importante pourrait être attribuée à l’interdiction de cartouches au plomb dans les fusils de chasse en vigueur depuis 199828.
Les niveaux de cadmium observés au Nunavik se situent à l’intérieur des valeurs de référence pour la population générale du Québec (1,8-55 nmol/l)11 et de celle recommandée par Santé Canada à 44,4 nmol/l29. Toutefois, en 2004, un tiers des individus et des femmes en âge de procréer ont des concentrations supérieures à celles recommandées. Entre 1992 et 2004, on observe une diminution des concentrations de 23 %. Il est peu probable que ce changement s’explique par les habitudes alimentaires étant donné que la principale source d’exposition au cadmium provient du tabac chez les Inuits30-31 et que l’association entre cadmium et tabac a été bien établie28,32,33. Il est possible que cette diminution des concentrations soit due à la diminution du cadmium dans les cigarettes vendues au Canada. Selon les données disponibles, il ne semble pas que le taux de fumeurs au Nunavik ait diminué de façon notable au cours des dernières années.
Conclusion
Ces résultats encourageants montrent clairement que les campagnes de prévention en santé publique, telles que celles reliées à l'utilisation de cartouches au plomb, peuvent réduire le degré d’exposition des Inuits aux métaux et ce faisant, les impacts sur leur santé. Il n’en demeure pas moins qu’une forte proportion d’individus et de femmes en âge de procréer affichent des concentrations sanguines au-dessus de celles considérées comme acceptables par l’Organisation mondiale de la santé, notamment pour le mercure et le cadmium. Des interventions en santé publique plus proactives et coordonnées à l'égard de l’usage du tabac devraient être encouragées afin de réduire le degré d'exposition au cadmium et prévenir les risques pour la santé que représentent le cancer du poumon, les maladies cardiovasculaires et l’asthme chez les enfants. Quant au mercure, il faudrait continuer de promouvoir la réduction de la consommation d’espèces marines contaminées, notamment chez les femmes enceintes et celles qui allaitent, de même que chez les femmes en âge de procréer.
Références
- ATSDR. (1999b). Toxicological profile for mercury. Atlanta: U.S. Department of Health and Human Services, Public Health Service.
- Castoldi, A. F., Coccini, T., Ceccatelli, S., & Manzo, L. (2001). Neurotoxicity and molecular effects of methylmercury. Brain Res Bull, 55 (2), 197-203.
- Counter, S. A., & Buchanan, L. H. (2004). Mercury exposure in children: a review. Toxicol Appl Pharmacol, 198 (2), 209-230.
- Grandjean, P., Weihe, P., White, R. F., Debes, F., Araki, S., Yokoyama, K., Murata, K., Sorensen, N., Dahl, R., & Jorgensen, P. J. (1997). Cognitive deficit in 7-year-old children with prenatal exposure to methylmercury. Neurotoxicol Teratol, 19 (6), 417-428.
- Debes, F., Budtz-Jorgensen, E., Weihe, P., White, R. F., & Grandjean, P. (2006). Impact of prenatal methylmercury exposure on neurobehavioral function at age 14 years. Neurotoxicol Teratol, 28 (3), 363-375.
- Saint-Amour, D., Roy, M. S., Bastien, C., Ayotte, P., Dewailly, É., Despres, C., Gingras, S., & Muckle, G. (2006). Alterations of visual evoked potentials in preschool Inuit children exposed to methylmercury and polychlorinated biphenyls from a marine diet. Neurotoxicology, 27 (4), 567-578.
- Després, C., Beuter, A., Richer, F., Poitras, K., Veilleux, A., Ayotte, P., Dewailly, É., Saint-Amour, D., & Muckle, G. (2005). Neuromotor functions in Inuit preschool children exposed to Pb, PCBs, and Hg. Neurotoxicol Teratol, 27 (2), 245-257.
- Weisskopf, M. G., Wright, R. O., Schwartz, J., Spiro, A., 3rd, Sparrow, D., Aro, A., & Hu, H. (2004). Cumulative lead exposure and prospective change in cognition among elderly men: the VA Normative Aging Study. Am J Epidemiol, 160 (12), 1184-1193
- Fraser, S., Muckle, G., & Després, C. (2006). The relationship between lead exposure, motor function and behaviour in Inuit preschool children. Neurotoxicol Teratol, 28 (1), 18-27.
- ATSDR. (1999a). Toxicological profile for cadmium. Atlanta: U.S. Department of Health and Human Services, Public Health Service.
- Leblanc, A., Lapointe, S., Beaudet, A., Côté, I., Dumas, P., Labrecque, F., Lamy, C., Larochelle, J., Lepage, L., Pelletier, F., Weber, J.-P., Levallois, P., & Gingras, S. (2004). Étude sur l’établissement de valeurs de référence d’éléments traces et de métaux dans le sang, le sérum et l’urine de la population de la grande région de Québec.Institut national de santé publique du Québec.
- Health Canada Mercury Issues Task Force. (2004). Mercury. Your health and the environment. A resource tool. Ottawa: Health Canada.
- Dewailly, É., Ayotte, P., Bruneau, S., Lebel, G., Levallois, P., & Weber, J. P. (2001). Exposure of the Inuit population of Nunavik (Arctic Quebec) to lead and mercury. Arch Environ Health, 56 (4), 350-357.
- Dumont, C., Girard, M., Bellavance, F., & Noël, F. (1998). Mercury levels in the Cree population of James Bay, Quebec, from 1988 to 1993/94. CMAJ, 158 (11), 1439-1445.
- Kosatsky, T., Przybysz, R., & Armstrong, B. (2000). Mercury exposure in Montrealers who eat St. Lawrence River sportfish. Environ Res, 84 (1), 36-43.
- Bjerregaard, P., & Hansen, J. C. (2000). Organochlorines and heavy metals in pregnant women from the Disko Bay area in Greenland. Sci Total Environ, 245 (1-3), 195-202.
- Grandjean, P., Weihe, P., Jorgensen, P. J., Clarkson, T., Cernichiari, E., & Videro, T. (1992). Impact of maternal seafood diet on fetal exposure to mercury, selenium, and lead. Arch Environ Health, 47 (3), 185-195.
- Mahaffey, K. R., & Mergler, D. (1998). Blood levels of total and organic mercury in residents of the upper St. Lawrence River basin, Quebec: association with age, gender, and fish consumption. Environ Res, 77 (2), 104-114.
- Cole, D. C., Kearney, J., Sanin, L. H., Leblanc, A., & Weber, J. P. (2004). Blood mercury levels among Ontario anglers and sport-fish eaters. Environ Res, 95 (3), 305 314
- Santé Québec, Jetté, M. (ed.) (1994). A Health Profile of the Inuit; Report of the Santé Québec Health Survey Among the Inuit of Nunavik, 1992. Montréal: Ministère de la Santé et des Services sociaux, Government of Québec.
- Health Canada, E. H. D., Federal-Provincial Committee on Environmental and Occupational Health. (1994). Update of evidence for low-level effects of lead and blood lead intervention levels and strategies. Otaaqa: Health Canada.
- Van Oostdam, J., Donaldson, S. G., Feeley, M., Arnold, D., Ayotte, P., Bondy, G., Chan, L., Dewaily, E., Furgal, C. M., Kuhnlein, H., Loring, E., Muckle, G., Myles, E., Receveur, O., Tracy, B., Gill, U., & Kalhok, S. (2005). Human health implications of environmental contaminants in Arctic Canada: A review. Sci Total Environ, 351-352, 165-246.
- Bjerregaard, P., Johansen, P., Mulvad, G., Pedersen, H. S., & Hansen, J. C. (2004). Lead sources in human diet in Greenland. Environ Health Perspect, 112 (15), 1496 1498.
- Chu, N. F., Liou, S. H., Wu, T. N., & Chang, P. Y. (1999). Reappraisal of the relation between blood lead concentration and blood pressure among the general population in Taiwan. Occup Environ Med, 56 (1), 30-33.
- Ducoffre, G., Claeys, F., & Bruaux, P. (1990). Lowering time trend of blood lead levels in Belgium since 1978. Environ Res, 51(1), 25-34.
- Hanning, R. M., Sandhu, R., MacMillan, A., Moss, L., Tsuji, L. J., & Nieboer, E. (2003). Impact on blood Pb levels of maternal and early infant feeding practices of First Nation Cree in the Mushkegowuk Territory of northern Ontario, Canada. J Environ Monit, 5 (2), 241 245.
- Kosatsky, T., Przybysz, R., Weber, J. P., & Kearney, J. (2001). Puzzling elevation of blood lead levels among consumers of freshwater sportfish. Arch Environ Health, 56 (2), 111-116.
- Lévesque, B., Duchesne, J. F., Gariépy, C., Rhainds, M., Dumas, P., Scheuhammer, A. M., Proulx, J. F., Déry, S., Muckle, G., Dallaire, F., & Dewailly, E. (2003). Monitoring of umbilical cord blood lead levels and sources assessment among the Inuit. Occup Environ Med, 60 (9), 693-695.
- INAC. (2003). Canadian Arctic Contaminants Assessment Report II, Human Health. Ottawa: Indian and Northern Affairs Canada.
- Benedetti, J. L., Dewailly, É., Turcotte, F., & Lefebvre, M. (1994). Unusually high blood cadmium associated with cigarette smoking among three subgroups of the general population, Quebec, Canada. Sci Total Environ, 152 (2), 161-167.
- Rey, M., Turcotte, F., Lapointe, C., & Dewailly, E. (1997). High blood cadmium levels are not associated with consumption of traditional food among the Inuit of Nunavik. J Toxicol Environ Health, 51(1), 5-14.
- Benedetti, J. L., Turcotte, F., Lefèbvre, M., Therrien, F., & Weber, J. P. (1992). Blood and urinary cadmium levels in Inuit living in Kuujjuaq, Canada. Sci Total Environ, 127 (1-2), 167-172.
- Butler Walker, J., Houseman, J., Seddon, L., McMullen, E., Tofflemire, K., Mills, C., Corriveau, A., Weber, J. P., LeBlanc, A., Walker, M., Donaldson, S. G., & Van Oostdam, J. (2006). Maternal and umbilical cord blood levels of mercury, lead, cadmium, and essential trace elements in Arctic Canada. Environ Res, 100 (3), 295 318.