L’intoxication au monoxyde de carbone chez les enfants
Mise en contexte
Le monoxyde de carbone (CO) est l’agent chimique le plus souvent impliqué dans les intoxications aiguës accidentelles déclarées à la Direction de santé publique de Montréal1. Le CO, gaz incolore, inodore, non irritant et toxique, se lie préférentiellement à l’hémoglobine pour former la carboxyhémoglobine (HbCO), diminuant ainsi la capacité du sang à transporter l’oxygène. Cet effet est augmenté par le déplacement de la courbe de dissociation de l’hémoglobine, diminuant la disponibilité de l’oxygène pour les tissus. En plus de sa réaction avec l’hémoglobine, le CO se combine à la myoglobine des cellules musculaires cardiaques et squelettiques ainsi qu’aux cytochromes et aux métalloenzymes tels que le cytochrome c oxydase et le cytochrome P-450. D’autres effets à la santé pourraient également être présents tels que les arythmies et l’ischémie cardiaque ainsi que les lésions de reperfusion cérébrale. La toxicologie du CO est donc relativement complexe et le processus d’intoxication ne relèverait pas uniquement d’un simple phénomène d’hypoxie cellulaire.
Les principaux signes et symptômes d’une intoxication au CO généralement rencontrés chez l’adulte comprennent des maux de tête, des étourdissements, des nausées, des vomissements, de la faiblesse, de la fatigue, de la confusion, une dyspnée, des changements dans la vision et, moins fréquemment, une douleur thoracique, une perte de conscience et des convulsions2. Étant donné la nature non spécifique des symptômes, un haut niveau de suspicion est donc essentiel pour diagnostiquer ce type d’intoxication. L’intoxication au CO peut être confondue avec un état grippal, une intoxication alimentaire, une migraine ou des problèmes psychiatriques.
Par ailleurs, il existe peu de données dans la littérature scientifique concernant l’intoxication pédiatrique au CO, même si les enfants en sont souvent victimes. Or, quelques articles scientifiques rapportent des différences importantes entre le portrait des intoxications chez les enfants et celui survenant chez les adultes. Nous présentons ici un cas d’intoxication relié à un système de chauffage au gaz naturel survenu dans une famille montréalaise, un exemple qui soulève certaines interrogations en lien avec l’intoxication des enfants au CO.
Cas récent d’intoxications au monoxyde de carbone
Le 19 octobre 2003, le Centre d’urgence 911 reçoit un appel d’une résidence de Montréal à 2h 07 du matin. Le propriétaire de la maison, qui ne se sentait pas bien depuis quelques jours, s’est éveillé cette nuit-là avec un sévère mal de tête. Son état s’est rapidement détérioré par la suite : nausées, vomissements, incontinence fécale, faiblesse généralisée et possible perte de conscience. En tenant compte de ce portrait et du fait que d’autres membres de cette famille de quatre personnes éprouvent des symptômes similaires, le préposé du 911 suspecte une exposition environnementale toxique, et dépêche ambulanciers et pompiers sur les lieux. À leur arrivée, les pompiers mesurent 150 ppm de CO sur le perron extérieur de la maison après ouverture de la porte avant et 900 ppm au deuxième étage, là où sont situées les chambres à coucher. Les pompiers procèdent donc immédiatement à l’évacuation des occupants et ventilent la résidence. En l’absence d’une intervention rapide, une telle exposition aurait pu entraîner des décès si l’on considère qu’une exposition à 1 000 ppm de CO durant cinq heures correspond à une HbCO d’environ 60 %3.
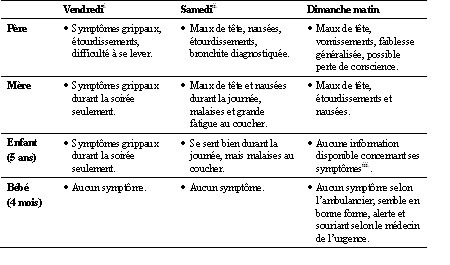
Deux jours plus tôt, le père était resté à la maison toute la journée car il présentait des symptômes au niveau des voies respiratoires supérieures. De plus, il se sentait étourdi et il avait de la difficulté à se lever. L’enfant de 5 ans était à l’école, tandis que la mère et le bébé de 4 mois avaient passé une bonne partie de la journée à l’extérieur de la maison. Cependant, durant la soirée, tous les membres de la famille ressentaient des symptômes s'apparentant au rhume. Le lendemain, les parents et l’enfant ont éprouvé différents symptômes, incluant des nausées, de la fatigue, des maux de tête et des étourdissements, alors qu'aucun problème de santé particulier n’a été constaté chez le bébé. Au cours de la journée, tous les membres de la famille ont passé un certain temps à l’extérieur de la maison, et le père a consulté en clinique où une bronchite a été diagnostiquée. Au coucher, tous éprouvaient des malaises importants, à l’exception du bébé. Ils ont été réveillés dans la nuit par le père dont l’état de santé s’aggravait. À l’arrivée des ambulanciers, le père présentait des symptômes plus sévères que ceux des autres membres de la famille, alors que le bébé semblait toujours en bonne forme. Le tableau 1 résume les symptômes des différents membres de la famille au cours de ces trois journées.
Tableau 1. Symptômes des membres de la famille au cours des trois jours
Durant le transport ambulancier et en milieu hospitalier, les membres de la famille ont été traités avec de l’oxygène à 100 % à des périodes de temps variables (voir la figure 1). Ainsi, le père a reçu de l’oxygène pendant deux heures, avant qu’une mesure subséquente n’indique une HbCO de 14 %. En raison de la gravité de ses symptômes, il a ensuite été transféré à l’Hôpital du Sacré-Cœur de Montréal pour un traitement d’oxygénothérapie hyperbarea. La mère a été transportée dans un centre hospitalier pédiatrique avec ses enfants où on a noté qu’elle était alerte, mais se sentait étourdie et nauséeuse. Elle a reçu de l’oxygène à 100 %, mais il est difficile d’établir la durée de l’oxygénothérapie avant la première mesure de HbCO de 20 % effectuée une heure et 45 minutes après l’alerte initiale. Une oxygénothérapie supplémentaire d’une heure a permis à sa HbCO de diminuer à 9 %.
Figure 1. Évolution du traitement des membres de la famille
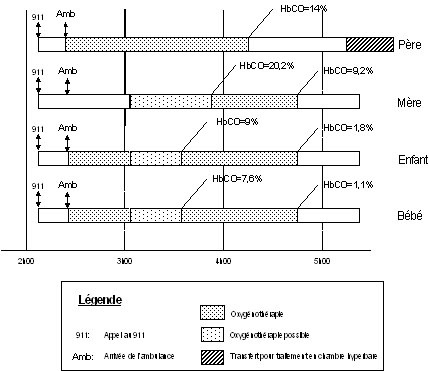
Il y a peu de renseignements concernant l’enfant de 5 ans, mais on sait que sa HbCO mesurée une heure et demie après l’alerte initiale était de 9 % et qu’elle a diminué à moins de 2 % après une heure d’oxygénothérapie à 100 %. Quant au bébé de 4 mois, selon les dires de sa mère ainsi que d'après l’information contenue dans son dossier médical, il était apparemment bien portant tout au long de l’événement et il était alerte et souriant. Sa HbCO, qui était de 8 % une heure et demie après l’événement, est revenue à la normale (moins de 2 %) après un peu plus d’une heure d’oxygénothérapie à 100 %.
La cause de l’accumulation de CO dans la résidence de cette famille a été identifiée après enquête. Au printemps 2003, la cheminée s’était effondrée et les propriétaires en avaient fait fermer la sortie afin d’empêcher les infiltrations d’eau. Ils croyaient alors qu’elle ne desservait qu’un ancien poêle à bois enlevé depuis plusieurs années. Or, elle servait également à l’évacuation des gaz de combustion du système de chauffage au gaz naturel. À partir du 17 octobre, la température extérieure s’étant rafraîchie significativement, les occupants ont mis en marche le système de chauffage de la résidence. Sans que ceux-ci en soient conscients, les gaz de combustion, ne pouvant plus être évacués à l’extérieur, se sont alors accumulés dans la maison. La température a chuté encore davantage durant la nuit du 18 au 19 octobre, expliquant l’augmentation des concentrations de CO à des valeurs aussi élevées que 900 ppm au deuxième étage de la résidence.
Relation entre les niveaux de HbCO et les symptômes
Les niveaux de HbCO habituellement rencontrés dans la population générale se situent entre 1 et 3 % chez les non-fumeurs, et jusqu’à 10 % chez les fumeurs. Des niveaux aussi élevés que 15 % ont déjà été rapportés chez de grands fumeurs2,4.
Bien que les niveaux de HbCO soient généralement corrélés à la symptomatologie rapportée, la HbCO est, dans certains cas, un indicateur imparfait de la sévérité de l’intoxication. Plusieurs facteurs peuvent influencer le niveau de HbCO mesuré, dont la durée et le niveau d’exposition au CO, l’administration d’oxygène ainsi que le délai entre l’arrêt de l’exposition et la prise de sang. Le diagnostic et le traitement doivent aussi reposer sur les données d’exposition, les circonstances de la maladie, l’histoire médicale et l’examen physique. Il faut donc retenir qu’un taux de HbCO élevé confirmera l’intoxication mais qu’un taux normal de HbCO n’exclura pas nécessairement le diagnostic d’intoxication franche et ne devra pas servir de seule base pour le choix d’un traitement.
La quantité de CO dans les tissus en comparaison avec celle dans le sang pourrait également expliquer, en partie, la variabilité de la corrélation entre le niveau de HbCO et la sévérité de l’intoxication5,6. La charge tissulaire en CO pourrait avoir un effet significatif sur l’état de santé d’une personne et ne pas être reflétée par le niveau de HbCO dans le sang. Selon certains auteurs2,5, la charge tissulaire serait déterminée principalement par la durée de l’exposition. Par exemple, une exposition prolongée à de faibles niveaux ambiants de CO pourrait occasionner une toxicité tissulaire élevée, des niveaux sanguins de HbCO modérés et des effets sévères et prolongés, tandis qu’une courte exposition à des niveaux très élevés de CO pourrait entraîner une toxicité tissulaire plus faible, des niveaux de HbCO élevés mais des effets rapidement réversibles et de courte durée. Ainsi, dans le cas des intoxications décrit précédemment, le père a présenté des symptômes plus sévères que ceux du reste de la famille, ce qui pourrait s’expliquer, entre autres, par la période de temps plus importante qu’il a passée à sa résidence au cours des trois journées entourant l’incident.
On considère généralement que la demi-vie de la HbCO est de plus de 5 heures à l’air ambiant, environ 80 minutes à 100 % d’oxygène à pression atmosphérique normale et moins de 30 minutes à 100 % d’oxygène en traitement hyperbare7. Il s’agit toutefois de valeurs moyennes, et la variabilité peut être importante chez les sujets. Ainsi, Weaver et coll. ont mesuré une demi-vie moyenne de la HbCO de 74 ± 25 minutes, chez 93 patients intoxiqués au CO, sous oxygénothérapie à 100 % à pression atmosphérique normale. L’étendue des résultats variait de 26 à 148 minutes5. En tenant compte du fait que le père a reçu de l’oxygène à 100 % durant son transport ambulancier et à l’hôpital, et en considérant une demi-vie de 80 minutes, on peut estimer son niveau initial de HbCO à environ 40 %. Ce niveau serait compatible avec les symptômes qu’il a présentés durant la nuit.
Intoxication pédiatrique au monoxyde de carbone
Malgré le fait que les enfants soient souvent victimes d’une intoxication au CO, l'information publiée sur les signes et les symptômes et leur corrélation avec le niveau de HbCO est en général basée sur des données obtenues chez les adultes. Néanmoins, certaines données laisseraient croire que l’intoxication au CO, en particulier chez le jeune enfant, se présenterait différemment de celle des adultes et que leur niveau de HbCO serait relié de façon moins évidente à la symptomatologie.
L’étude d’une série de 14 cas d’intoxication au CO chez des enfants de moins de 2 ans a démontré une très mauvaise corrélation entre les symptômes présentés, les niveaux de HbCO et l’apparente sévérité de l’intoxication dans ce groupe d’âge8. En fait, un tiers des enfants étaient asymptomatiques à la suite de leur exposition au CO et n’ont bénéficié de soins médicaux que parce d’autres membres de leur famille étaient symptomatiques. Les niveaux de HbCO chez les enfants asymptomatiques variaient de 11,8 à 34,4 %, tandis qu’ils variaient de 7,5 à 24,2 % pour les enfants symptomatiques sans apparente corrélation entre la présentation clinique et les niveaux de HbCO. Les signes et symptômes les plus fréquemment observés dans ce groupe d’âge étaient un niveau de conscience altéré (difficulté à réveiller l’enfant, léthargie), de l’irritabilité, des vomissements et une diminution de l’appétit.
Lors du cas décrit précédemment, nous avons observé un phénomène semblable chez le bébé de 4 mois. Bien que son exposition au CO ait été comparable à celle de sa mère et que son berceau était placé dans la chambre de ses parents, celui-ci n’a présenté aucun symptôme évident d’intoxication au CO, même au moment où les concentrations semblaient élevées.
Une revue de 28 cas d’exposition au CO chez les enfants a par ailleurs démontré une corrélation plus claire entre les symptômes et les niveaux de HbCO9. Parmi ces cas, 12 enfants qui présentaient une HbCO inférieure à 15 % étaient asymptomatiques et n’ont pas été retenus dans l’analyse. Chez les 16 cas restants, les niveaux de HbCO variaient de 16,7 à 44 %. La moyenne d’âge était de 7 ans (8 mois -14 ans, dont deux d’entre eux avaient moins de 2 ans) et les principaux symptômes observés étaient nausées, vomissements, céphalées, léthargie et syncope. La particularité de la symptomatologie observée dans ce groupe d’enfants un peu plus âgés, est la présence de léthargie et de syncope à des niveaux de HbCO inférieurs à ceux généralement observés chez les adultes. La léthargie a été rapportée chez 11 des 16 cas à des niveaux de HbCO débutant à 18,6 % et tous les enfants ayant une HbCO supérieure ou égale à 24,3 % (9/16) ont été victimes d'une syncope. D’après les auteurs, ces symptômes se manifestent habituellement chez les adultes à des niveaux de HbCO supérieurs à 40 %. Notons toutefois que les auteurs ne rapportent pas le délai entre l’arrêt de l’exposition et/ou l’administration d’oxygène chez les enfants avant le dosage de la HbCO.
Chez l’enfant, l’intoxication au CO peut être confondue avec un état grippal. Des auteurs ont mesuré la HbCO chez des enfants non fiévreux présents à l’urgence pour des symptômes d’allure grippal sans histoire précise d’exposition au CO10. Parmi les 46 enfants retenus pour l’étude, 24 (52 %) présentaient une HbCO supérieure à 2 % (2,7 à 27,6 %), soit la limite supérieure normale de HbCO retenue pour cette population. Les sources d’exposition identifiées ont été les gaz d’échappement d’automobile, des fournaises à l’huile et au kérosène ainsi que des poêles au gaz.
Les enfants répondent en général très bien à l’oxygénothérapie. Tout comme pour les adultes, la controverse demeure quant aux bénéfices relatifs du traitement hyperbare par opposition au traitement à pression atmosphérique normale, particulièrement en ce qui concerne les séquelles neurologiques possibles11,12. Toutefois, l’élimination du CO sous oxygénothérapie pourrait être plus rapide chez les enfants que chez les adultes. Selon une revue effectuée par Vreman et coll., la demi-vie de la HbCO chez les nouveaux-nés serait plusieurs fois plus courte que celle des adultes en raison des taux respiratoires plus élevés de ces enfants et de leur volume de sang plus petit13. Les résultats d’une enquête d’une exposition de masse au CO dans une école élémentaire (moyenne d’âge de 8,7 ans) à St. Louis au Missouri ont été publiés en 199814. La valeur moyenne de la HbCO initiale de 147 enfants était de 7 %. Un contrôle effectué chez 26 enfants, à la suite à l’administration d’oxygène à 100 %, a démontré une valeur moyenne de la HbCO de 2,7 %. La demi-vie moyenne de la HbCO a été calculée à 44 minutes s'avérant ainsi plus courte que celle habituellement rapportée chez les adultes.
Les niveaux de HbCO et la demi-vie de la HbCO des enfants de la famille montréalaise semblent également différents de ceux de leurs parents (voir la figure 1). À partir des deux mesures du niveau de la HbCO, la demi-vie de la HbCO de la mère serait du même ordre de grandeur que la demi-vie moyenne citée dans la littérature. Toutefois, chez les deux enfants, le niveau de HbCO aurait diminué de deux demi-vies sur une période d’environ 80 minutes.
Au Québec, une revue des cas de décès attribuables au CO de 1989 à 2000 a identifié 13 événements associés à des cheminées obstruées ou à des problèmes de fonctionnement d’un système de chauffage fixe dans une habitation permanente (poêle à bois, fournaise au gaz naturel, huile ou propane, poêle à combustion lente, générateur d’air chaud). Ces événements ont causé 17 décès et 5 intoxications non létales. Ces intoxications comptent pour 9,7 % des événements et 11,1 % des décès accidentels attribuables au CO issus de la base de données du coroner. Les personnes décédées, 13 hommes et 4 femmes, étaient âgées de 17 à 79 ans (moyenne de 57,5 ans). Dans deux cas, un avertisseur de CO était présent mais non fonctionnel. Il n’y a que deux enfants de moins de 12 ans pour l’ensemble des décès accidentels attribuables au CO au fichier du coroner de 1989 à 2000 (Claude Prévost, DSP de la Montérégie, communication personnelle).
À Montréal, de 1997 à ce jour, les intoxications pédiatriques au CO (0-14 ans) déclarées représentent 54 % (22/37) des cas d’origine environnementale, dont 1 décès récent dans une automobile enneigée.
Conclusion
L’intoxication au CO chez les jeunes enfants et les bébés peut se présenter de façon fort différente de celle de l’adulte. En effet, tel que rapporté dans la littérature, ceux-ci présentent parfois une symptomatologie peu marquée, même lors d’une intoxication franche, en particulier chez les enfants de moins de 2 ans. L’intoxication au CO étant fréquemment collective, les enfants associés à ces événements devraient donc toujours être évalués médicalement même en l’absence de toute symptomatologie. Par ailleurs, l’état de santé des enfants pourrait se détériorer rapidement d’un point de vue neurologique à des niveaux de HbCO inférieurs à ceux que l’on observe chez les adultes. Il est donc d’autant plus important d’être vigilant face à cette population. Les enfants répondent en général très bien à l’oxygénothérapie. La demi-vie de la HbCO chez les enfants semblerait toutefois plus courte que celle également rapportée chez les adultes.
L’intoxication au CO peut être confondue avec un état grippal. Ceci soulève l’importance d’obtenir une histoire environnementale détaillée, principalement en période hivernale, chez les enfants (mais aussi chez les adultes) non fiévreux, se présentant avec des symptômes d’allure grippale compte tenu du mimétisme possible de cette symptomatologie lors d’une intoxication au CO. En plus du diagnostic et du traitement appropriés à prodiguer à ces patients, il est également essentiel de procéder au diagnostic environnemental afin de prévenir d’autres intoxications.
Il nous apparaît important que ces particularités soient connues de la population et des médecins, et documentées davantage. L’intoxication au CO est un phénomène complexe pouvant occasionner des séquelles à long terme, d’où l’importance d’un diagnostic précoce et d’un traitement approprié. L’intoxication au CO est une maladie à déclaration obligatoire par les médecins et par les dirigeants d’un laboratoire ou d’un département de biologie médicale. Les situations à risque mises en évidence par la déclaration des cas permettent une meilleure connaissance de la problématique et des mesures à mettre en place pour prévenir la survenue d’autres cas.
Références
- Provencher, S. et S. Brisson, 2002. Maladies à déclaration obligatoire par agents chimiques: Région de Montréal-Centre, 1998-2000.
- Ernst, A. et J. D. Zibrak, 1998. Carbon monoxide poisoning. New Eng J. Med., 339 : 1603-8.
- Vyskocil, A., Viau, C. et J. Brodeur, 1996. Monoxyde de carbone. 196 p.
- Abelsohn, A., Sanborn, M. D., Jessiman, B. J. et E. Weir, 2002. Identifying and managing adverse environmental health effects: 6. Carbon monoxide poisoning. CMAJ, 166 : 1685-90.
- Weaver, L. K., Howe, S., Hopkins, R. et K. J. Chan, 2000. Carboxyhemoglobin half-life in carbon monoxide-poisoned patients treated with 100% oxygen at atmospheric pressure. Chest, 117 : 801-8.
- WHO, 1999. Environmental Health Criteria 213 : Carbon monoxide.
- Raub, J. A., Mathieu-Nolf, M., Hampson, N. B. et S. R. Thom, 2000. Carbon Monoxide Poisoning - a Public Health Perspective. Toxicol., 145 : 1-14.
- Rudge, F. W., 1993. Carbon monoxide poisoning in infants: Treatment with hyperbaric oxygen. South Med. J., 86 : 334-7.
- Crocker, P. J. et J. S. Walker, 1985. Pediatric carbon monoxide toxicity. J. Emerg. Med., 3 : 443-8.
- Baker, M. D., Henretig, F. M., et S. Ludwig, 1988. Carboxyhemoglobin levels in children with nonspecific flu-like symptoms. J. Pediatr., 113 : 501-4.
- Liebelt, E. L., 1999. Hyperbaric oxygen therapy in childhood carbon monoxide poisoning. Curr. Opin. Pediatr., 11 : 259-64.
- Meert, K. L., Heidemann, S. M., et A. P. Sarnaik, 1998. Outcome of children with carbon monoxide poisoning treated with normobaric oxygen. J. Trauma, 44 : 149-54.
- Vreman, H. J., Mahoney, J. J., et D. K. Stevenson, 1995. Carbon monoxide and carboxyhemoglobin. Adv. Pediatr., 42 : 303-34.
- Klasner, A. E., Smith, S. R., Thompson, M. W., et A. J. Scalzo, 1998. Carbon monoxide mass exposure in a pediatric population. Acad. Emerg. Med, 6 : 766-8.
a Le principe du traitement hyperbare consiste à administrer 100 % d’oxygène au patient installé dans un caisson métallique pressurisé jusqu’à 3 atmosphères et vise à faciliter l’élimination rapide du CO sanguin et tissulaire.
Nous tenons à remercier le Dr Claude Prévost de la Direction de santé publique de la Montérégie pour nous avoir fourni les données du fichier du coroner concernant les décès par intoxication au monoxyde de carbone au Québec.

