Effets génotoxiques d’une exposition combinée aux HAP et au rayonnement UV
T. Douki, Laboratoire des Lésions des Acides Nucléiques, France
Z. Ksoury, Laboratoire des Lésions des Acides Nucléiques, France
C. Marie, , Laboratoire des Lésions des Acides Nucléiques, France et Médecine et Santé au Travail, EPSP-TIMC UMR 5525, Faculté de Médecine, La Tronche, France
J-L. Ravanat, Laboratoire des Lésions des Acides Nucléiques, France
A. Maitre, Médecine et Santé au Travail, EPSP-TIMC UMR 5525, Faculté de Médecine, La Tronche, France.
Introduction
Les organes cibles des effets cancérigènes des hydrocarbures polycycliques aromatiques et en particulier du benzo[a]pyrène (BaP) comprennent la vessie, les poumons, mais aussi la peau. Dans ce dernier cas, un effet synergique avec le rayonnement solaire est à considérer pour les zones cutanées exposées. En effet, le BaP et ses métabolites sont des molécules qui absorbent efficacement le rayonnement ultraviolet, en particulier les UVA, et peuvent jouer le rôle de photosensibilisateurs. Des travaux ont déjà montré une action synergique entre BaP et rayonnement ultraviolet pour l’induction de mutations au niveau cellulaire ainsi que de tumeurs dans la peau chez la souris (Wang et al., 2005; Yoon et al., 2003).
Au niveau moléculaire, l’accent est mis sur les dommages oxydatifs puisque le stress oxydant est la conséquence majeure de la plupart des processus de photosensibisation. L’induction de cassures simple et double-brin de l’ADN (Crallan et al., 2005; Toyooka et Ibuki, 2005) a été montrée, ainsi que la formation de 8-oxo-7, 8-dihydro-2'-désoxyguanosine (8- oxodGuo) (Gao et al., 2005; Routledge et al., 2001; Zhang et al., 2004). Les mécanismes sousjacents et les espèces réactives de l’oxygène impliqués dans l’induction de ces lésions restent mal définis. Des études aux résultats ambigus mettant en oeuvre des piégeurs plus ou moins spécifiques concluent à l’implication soit de l’oxygène singulet (Toyooka and Ibuki, 2005) produit par transfert de l’énergie du photosensibilisateur excité vers l’oxygène moléculaire, soit de l’anion superoxyde et du peroxyde d’hydrogène (Gao et al., 2005; Shyong et al., 2003).
Pour obtenir plus d’informations mécanistes, nous avons déterminé le rendement de plusieurs bases oxydées dans l’ADN isolé. En effet, l’oxygène singulet n’induit que la 8-oxodGuo. La photosensibilisation de type I avec transfert d’électron de l’ADN vers le photosensibilisateur excité conduit majoritairement à des dommages de la guanine. À l’inverse, le radical hydroxyle induit la dégradation de toutes bases. De l’ADN génomique isolé a donc été exposé aux UVA en présence de BaP, de son métabolite diol époxyde (BPDE) ou du tétraol qui en dérive par hydrolyse. Les bases oxydées produites ont été quantifiées par HPLC couplée à la spectrométrie de masse en mode tandem (HPLC-MS/MS) après hydrolyse enzymatique de l’ADN en nucléosides.
Matériels et méthodes
Produits chimiques et enzymes
Le BaP et le (±)-anti-BPDE sont obtenus auprès du National Cancer Institute (Bethesda, MD). L’acétophénone, le bleu de méthylène, la riboflavine, l’ADN génomique de thymus de veau, la nucléase P1 (penicillium citrium), la phosphodiestérase II, la phosphodiestérase I (Crotalus adamentus venom) et la phosphatase alcaline sont des produits Sigma (St Quentin- Fallavier, France). Les solvants utilisés sont de qualité analytique ou supérieure.
Irradiation UVA de l’ADN
Une solution aqueuse d’ADN (0,1 mg/ml) dans 0.1 M NaCl contenant 10 μm de photosensibilisateur est préparée. Des contrôles sont exposés aux UVA sans photosensibilisateurs. Les échantillons sont irradiés avec une lampe Waldman UVA 700L (Waldman, Villingen-Schwenningen, Allemagne) dont le spectre d’émission contient uniquement des photons de longueur d’onde supérieure à 330 nm. Après irradiation, l’ADN est précipité par ajout d’éthanol froid (2,5 ml) afin d’en éliminer le photosensibilisateur, puis est solubilisé dans de l’eau pure.
Quantification des dommages de l’ADN
L’ADN est digéré en un mélange de nucléosides en deux étapes. Premièrement, l’échantillon est incubé pendant 2 h à 37 °C à pH 6 en présence de nucléase P1, de phosphodiestérase II et de DNAse II. Le pH est ensuite ajusté à 8 et l’échantillon est à nouveau incubé 2 h à 37 °C en présence de phosphodiestérase I et de phosphatase alcaline. Les échantillons sont ensuite analysés par HPLC-MS/ MS. La séparation HPLC est réalisée sur colonne C18 en utilisant un gradient d’acétonitrile dans une solution aqueuse de formiate d’ammonium (pH 6,3). Le système HPLC est connecté à spectromètre de masse électrospray triple quadripolaire API 3000 (MDS SCIEX / Applied Biosystems, Concord, Canada). Le diol de thymidine (diol Thd), la 5 (hydroxymethyl) 2 désoxyuridine (5 HMdUrd), la 5 formyl 2' désoxyuridine (5 Ford Urd), la 8-oxodGuo et les adduits BPDE-N2-dGuo ont été quantifiés en suivant en continu l’intensité des ions issus de réactions de fragmentation spécifiques de chaque analyte. La quantité d’ADN analysée est calculée à partir de celle des nucléosides normaux quantifiés en ligne par absorption UV.
Résultats
Comparaison du BaP avec d’autres photosensibilisateurs
Des échantillons d’ADN sont exposés à des doses croissantes d’UVA en présence de 10 μM de BaP ou de molécules connues pour leur propriété de photosensibilisateurs (acétophénone, riboflavine, bleu de méthylène). Alors qu’une induction très nette de 8-oxodGuo est observée pour ces derniers composés, l’augmentation par rapport à des échantillons exposés aux UVA seuls est à peine visible dans le cas du BaP. Le BaP ne peut donc pas être considéré comme un bon photosensibilisateur.
Photosensibilisation comparée de l’ADN par le BaP, le BPDE et le tétraol
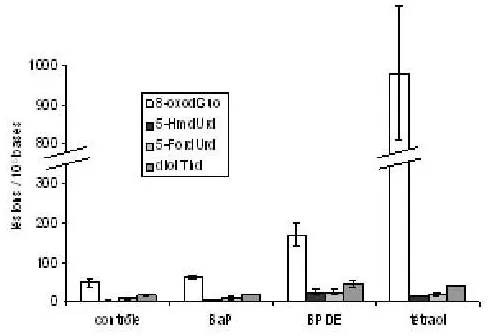
Des échantillons d’ADN sont ensuite exposés aux UVA en présence de BaP, de son métabolite BPDE ou du produit d’hydrolyse de ce dernier, le tétraol. On observe clairement que le BPDE et le tétraol sont plus efficaces que le BaP pour oxyder l’ADN. De plus, la 8-oxodGuo est quasiment la seule base oxydée produite par action du tétraol, alors que l’on observe aussi la formation, en plus faible quantité, de produit d’oxydation de la thymine avec le BPDE (figure1). Les proportions respectives de 8-oxodGuo parmi les bases oxydées sont de 93 et 64 %. La formation des produits d’oxydation de la thymine par photosensibilisation par le BPDE ne s’explique pas par la production de radicaux hydroxyles puisque l’ajout de tris, un piégeur efficace de cette espèce oxydante, n’en diminue pas le rendement. Ces données indiquent que le tétraol agit plutôt par production d’oxygène singulet alors que le BPDE implique une oxydation à un électron.
Figure 1. Taux de bases oxydées dans des échantillons d’ADN isolé photosensibilisé par les UVA (30 J.cm 2) seuls ou en présence de 10 μM de BaP, BPDE ou tétraol
Rôle des adduits du BPDE à l’ADN dans les réactions de photosensibilisation
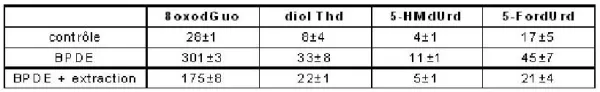
Le taux d’adduits du BPDE en position N2 de la guanine est déterminé par HPLC-MS/MS comme étant d’environ 600 lésions pour 106bases normales. Afin de déterminer la contribution éventuelle des adduits aux processus de photosensibilisation par les UVA, les composés organiques non liés à l’ADN après incubation avec du BPDE ont été extraits à l’acétate d’éthyle. La solution aqueuse obtenue a été exposée aux UVA et les bases oxydées y ont été quantifiées. Un rendement 2 fois moindre qu’en l’absence d’extraction est observé, alors que les adduits à l’ADN représentent moins de 2 % du BPDE introduit.
Tableau 1. Effet d’une extraction par l’acétate d’éthyle sur la formation photosensibilisée par le BPDE de bases oxydées dans l’ADN isolé. La dose d’UVA appliquée est de 50 J.cm-2.
Conclusion
Nos résultats montrent que si le BaP n’est pas un bon photosensibilisateur de l’ADN aux UVA, le BPDE et le tétraol sont plus efficaces. L’implication de ce dernier composé dans nos expériences avec le BPDE semble limitée puisqu’il conduit quasi-exclusivement à la formation de 8-oxodGuo alors que la photosensibilisation par le BPDE induit aussi l’oxydation de la thymine. Enfin, les molécules de BPDE impliquées dans des adduits à l’ADN sont particulièrement efficaces pour induire des dommages. Ceci peut facilement s’expliquer par la proximité des noyaux aromatiques et des bases nucléiques. Ces données restent bien sûr à valider au niveau cellulaire. L’importance de l’effet photo-génotoxique du BaP en fonction des capacités de métabolisation des cellules est aussi un paramètre particulièrement intéressant.
Bibliographie
- Crallan, R. A., Ingham, E., and Routledge, M. N. (2005). Wavelength dependent Tableau 1. Effet d’une extraction par l’acétate d’éthyle sur la formation photosensibilisée par le BPDE de bases oxydées dans l’ADN isolé. La dose d’UVA appliquée est de 50 J.cm-2. responses of primary human keratinocytes to combined treatment with benzo [a]pyrene and UV light. Mutagenesis 20, 305-310.
- Gao, D., Luo, Y., Guevara, D., Wang, Y., Rui, M., Goldwyn, B., Lu, Y., Smith, E. C., Lebwohl, M., and Wei, H. (2005). Benzo[a]pyrene and its metabolites combined with ultraviolet A synergistically induce 8-hydroxy-2'-deoxyguanosine via reactive oxygen species. Free Radic. Biol. Med. 39, 1177-1183.
- Routledge, M. N., McLuckie, K. I., Jones, G. D., Farmer, P. B., and Martin, E. A. (2001). Presence of benzo[a]pyrene diol epoxide adducts in target DNA leads to an increase in UV-induced DNA single strand breaks and supF gene mutations. Carcinogenesis 22, 1231-1238.
- Shyong, E. Q., Lu, Y., Goldstein, A., Lebwohl, M., and Wei, H. (2003). Synergistic enhancement of H2O2 production in human epidermoid carcinoma cells by Benzo[a]pyrene and ultraviolet A radiation. Toxicol. Appl. Pharmacol. 188, 104-109.
- Toyooka, T., and Ibuki, Y. (2005). Coexposure to benzo[a]pyrene and UVA induces phosphorylation of histone H2AX. FEBS Lett. 579, 6338-6342.
- Wang, Y., Gao, D., Atencio, D. P., Perez, E., Saladi, R., Moore, J., Guevara, D., Rosenstein, B. S., Lebwohl, M., and Wei, H. (2005). Combined subcarcinogenic benzo[a]pyrene and UVA synergistically caused high tumor incidence and mutations in H-ras gene, but not p53, in SKH-1 hairless mouse skin. Int. J. Cancer 116, 193-199.
- Yoon, J. H., Lee, C. S., and Pfeifer, G. P. (2003). Simulated sunlight and benzo[a]pyrene diol epoxide induced mutagenesis in the human p53 gene evaluated by the yeast functional assay: lack of correspondence to tumor mutation spectra. Carcinogenesis 24, 113-119.
- Zhang, X., Wu, R. S., Fu, W., Xu, L., and Lam, P. K. (2004). Production of reactive oxygen species and 8-hydroxy- 2’deoxyguanosine in KB cells co-exposed to benzo[a]pyrene and UV-A radiation. Chemosphere 55, 1303-1308.