Cinétiques de formation et de réparation des adduits de l’ADN du benzo[a]pyrène
C. Marie(1,2), A. Maitre(2), T. Douki(1), M. Gateau(1†), A. Tarantini(2), P. Guiraud(2), A. Favier(1), J-L. Ravanat(1)
(1) Laboratoire des Lésions des Acides Nucléiques, LCIB (UMR-E 3 CEA-UJF), DRFMC, CEA/ Grenoble, 17 Avenue des Martyrs, 38054 Grenoble Cedex 9, France. (2)Médecine et Santé au Travail, EPSP-TIMC UMR 5525, Faculté de Médecine, Domaine de la Merci, 38700 La Tronche, France.
Introduction
Du fait de la cancérogénicité de certains hydrocarbures aromatiques polycycliques (HAP) (Boffetta et al., 1997; Mastrangelo et al., 1996; Straif et al., 2005), comme le benzo[a]pyrène (B[a]P) classé dans le groupe 1 du CIRC en 2005 (Straif et al., 2005), il apparaît primordial d’évaluer l’exposition des individus à ces substances. La surveillance biologique de l’exposition aux HAP est classiquement réalisée par la mesure du 1-hydroxypyrène urinaire, métabolite majoritaire du pyrène. Toutefois le pyrène n’est pas un HAP cancérigène et il s’agit désormais de développer de nouveaux biomarqueurs d’exposition spécifiques des HAP cancérigènes. Parmi eux, les adduits de l’ADN du B[a]P semblent particulièrement intéressants puisqu’ils représentent la dose efficace au plus près du site d’action toxique des HAP. Le B[a]P exerce son action toxique après métabolisation, laquelle comprend trois voies principales. La première implique les cytochromes P450 qui conduisent à la formation du BPDE. Ce diol-époxyde est capable de se lier à l’ADN pour former majoritairement des adduits stables sur les groupements exocycliques de la 2’-désoxyguanosine (dGuo) et de la 2’-désoxyadénosine (dAdo). La seconde voie de métabolisation correspond à une oxydation mono-électronique du B[a]P par des péroxydases et les cytochromes P450 formant des radicaux cations du B[a]P. Ces radicaux entraînent la formation de différents adduits et principalement en positions C8 de la guanine (Gua) et N7 de la Gua et de l’adénine (Ade). La dernière voie consiste en une oxydation de dihydrodiols du B[a]P en catéchols par des dihydrodiols déshydrogénases. Ces catéchols sont convertis en quinones du B[a]P qui peuvent générer des cycles d’oxydoréductions et conduire à la formation d’espèces réactives de l’oxygène. La formation des adduits de l’ADN du B[a]P semble résulter principalement des voies de métabolisation du BPDE et du radical cation. Nous avons donc choisi d’étudier les adduits issus de ces deux voies métaboliques simultanément.
Une méthode de dosage spécifique et sensible de ces adduits a été mise au point par chromatographie liquide haute performance couplée à la spectrométrie de masse en mode tandem (HPLC-MS/MS) dans le but de définir au niveau cellulaire les adduits majoritaires. Les cinétiques de formation et de réparation de ces adduits ont été étudiées, en vue de mieux caractériser ces potentiels biomarqueurs d’exposition aux HAP.
Matériels et méthodes
Synthèse des adduits de l’ADN
Les adduits sont synthétisés par action de 1,5 μmoles de (±)-anti- 7,8-dihydroxy-9,10-époxy- 7,8,9,10-tétrahydrobenzo[a] pyrène ((±)-anti-BPDE) sur de l’ADN isolé (4 mg) dans 2 mL d’eau désionisée. Après précipitation, dissolution dans l’eau, l’ADN est digéré enzymatiquement. Les adduits sont purifiés sur un système de HPLC-MS/MS avant d’être calibrés par spectroscopie UV (Marie et al., 2007).
Dosage par HPLC-MS/MS
Le système consiste en un appareil Agilent 1100 HPLC équipé d’une pompe binaire, un injecteur automatique thermostaté et un détecteur UV, couplé à un spectromètre de masse API 3000 de Applied Biosystems comprenant une source de type électrospray et un analyseur triple quadripolaire en mode tandem. Pour améliorer la sensibilité de la détection, tous les paramètres du spectromètre de masse sont optimisés pour chaque adduit. Les adduits et les nucléosides normaux sont quantifiés par calibration externe, les nucléosides étant dosés par détection UV à 270 nm. La chromatographie est effectuée sur une colonne Uptisphere C8 (150 * 2 mm d.i. 3 μm) d’Interchim. L’élution est linéaire de 0 % à 100 % d’acétonitrile dans le formiate d’ammonium 2 mM pendant 30 min à un débit de 0,2 mL/min.
Études cellulaires
Les lignées choisies pour l’étude sont les lignées HaCat et HepG2, issues de kératinocytes humains immortalisés et d’un hépatocarcinome humain respectivement. Les cellules sont ensemencées dans des flacons de 25 cm2 à une densité de 8*104 cellules/cm2. Après trois jours de croissance les cellules sont traitées avec du (±)-anti-BPDE ou du B[a]P dissous dans le DMSO à des concentrations et pour des durées variables selon les expériences. Lors de l’étude de la réparation des adduits, les cellules sont lavées après un traitement au B[a]P ou au BPDE puis remises en culture dans du milieu de culture propre. Pour la mesure des adduits, les cellules sont lavées et récoltées par tryspination, et l’ADN est ensuite extrait selon une méthode chaotropique (Ravanat et al., 2002). L’ADN est enfin digéré enzymatiquement puis analysé par HPLC-MS/MS.
Résultats
Synthèse des adduits de l’ADN
La synthèse des adduits de la voie du BPDE a permis d’obtenir deux adduits stables, BPDE-N2-dGuo et BPDE-N6-dAdo. La synthèse des adduits du radical cation a produit trois adduits stables et deux adduits dépurinants potentiellement identifiés comme étant B[a]P-C8- dGuo, B[a]P-N2-dGuo B[a]P-N3- dGuo et B[a]P-N7-Gua, B[a]P-C8- Gua respectivement. Une méthode de dosage par HPLC-MS/MS a ensuite été mise au point pour permettre la détection de ces sept adduits en une même analyse. La limite de détection obtenue est d’environ 1 adduit/108 nucléosides normaux pour 100 μg d’ADN.
Études cellulaires - Exposition au B[a]P
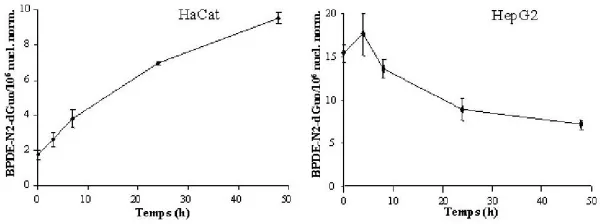
L’adduit majoritairement formé dans les cellules HaCat et HepG2 traitées au B[a]P est l’adduit BPDEN2- dGuo. La cinétique de formation de cet adduit en présence de B[a]P est de type exponentiel dans les deux lignées, et il s’agit d’une cinétique lente puisque le niveau d’adduits augmente jusqu’à 24 heures après le début du traitement. En présence de B[a]P, la formation des adduits est dose-dépendante dans les deux types cellulaires, mais les niveaux d’adduits sont deux ordres de grandeur plus élevés dans les cellules HepG2 que dans les cellules HaCat. Aucun adduit de la voie du radical cation n’est détecté dans les deux types cellulaires, même à des doses élevées de B[a]P. L’adduit BPDE-N6-dAdo est détecté dans les cellules HepG2 et représente environ 30% de la formation de l’adduit BPDE-N2- dGuo. L’étude de la réparation des adduits en présence de B[a]P indique une cinétique différente entre les deux lignées (figure 1). Dans les cellules HepG2, le taux de l’adduit BPDE-N2-dGuo atteint son maximum rapidement après l’arrêt de l’incubation avec le B[a]P, puis décroît indiquant que les cellules réparent les adduits formés. À l’inverse, le taux de l’adduit BPDEN2- dGuo continue à croître dans les cellules HaCat 48 heures après l’arrêt du traitement au B[a]P.
Figure 1. Évolution du taux de l’adduit BPDE-N2-dGuo après un traitement pendant 24 h à 200 μM et 10 μM de B[a]P pour les cellules HaCat et HepG2 respectivement. Les adduits sont mesurés à 3, 7, 24, 48 h et 4, 8, 24, et 48 h après le traitement des cellules HaCat et HepG2 respectivement.
Études cellulaires - Exposition au BPDE
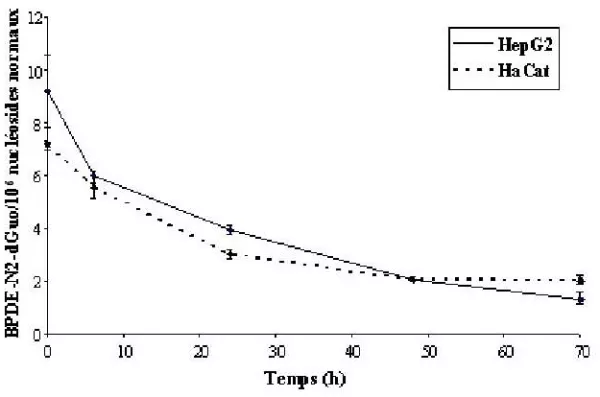
Les deux adduits stables BPDEN2- dGuo et BPDE-N6-dAdo sont détectés dans l’ADN des cellules HaCat et HepG2 traitées au (±)- anti-BPDE. L’adduit BPDE-N6- dAdo représente environ 30 % de la formation de l’adduit BPDEN2- dGuo. La cinétique de formation des adduits est rapide puisque le maximum est atteint environ 1 heure après le début du traitement. La formation des adduits est linéaire dose-dépendante, et les niveaux d’adduits obtenus sont similaires dans les deux lignées. De même, la cinétique de réparation des adduits du BPDE est identique dans les deux types cellulaires (figure 2).
Il s’agit d’une réparation lente puisque 25 % des adduits persistent 48 heures après la fin du traitement. De plus, en considérant la cinétique à partir de T = 6 h, on obtient une monoexponentielle avec un R2 = 0,997. La cinétique de réparation de l’adduit BPDEN2- dGuo est donc une cinétique monophasique.
Figure 2. Cinétique de réparation de l’adduit BPDE-N2-dGuo dans les cellules HaCat et HepG2 traitées à 0,5 μM de (±)-anti-BPDE pendant 1 h. Les adduits sont mesurés 6, 24, 48 et 70 heures après l’arrêt du traitement.
Conclusion
Selon cette étude, l’adduit BPDEN2- dGuo apparaît comme un biomarqueur pertinent de l’exposition au B[a]P. En effet, sa formation est dose-dépendante et sa réparation est lente. Il apparaît également que la cinétique de formation de cet adduit peut varier selon les capacités de métabolisation des tissus. Il semble alors intéressant de reproduire ce travail sur les types cellulaires généralement prélevés chez l’homme comme les lymphocytes ou encore les cellules endobuccales. De plus, aucun adduit de la voie du radical cation n’a été détecté dans l’ADN des cellules traitées au B[a]P. Une hypothèse probable serait le caractère majoritairement dépurinant de ces adduits qui présenteraient alors l’avantage de pouvoir être retrouvés dans l’urine chez l’homme.
Bibliographie
- Boffetta, P., Jourenkova, N. and Gustavsson, P. (1997). Cancer risk from occupational and environmental exposure to polycyclic aromatic hydrocarbons. Cancer Causes Control 8, 444-72.
- Mastrangelo, G., Fadda, E. and Marzia, V. (1996). Polycyclic aromatic hydrocarbons and cancer in man. Environ Health Perspect. 104, 1166-70.
- Straif, K., Baan, R., Grosse, Y., Secretan, B., El Ghissassi, F. and Cogliano, V. (2005). Carcinogenicity of polycyclic aromatic hydrocarbons. Lancet Oncol. 6, 931-2.
- Marie, C., Maitre, A., Douki, T., Gateau, M., Tarantini, G. and Ravanat, J. L. (2007). Influence of the metabolic properties of human cells on the kinetic of formation of the major benzo[a]pyrene DNA adducts. J. Appl. Tox. 28, 579-90.
- Ravanat, J. L., Douki, T., Duez, P., Gremaud, E., Herbert, K., Hofer, T., Lasserre, L., Saint-Pierre, C., Favier, A. and Cadet, J. (2002). Cellular background level of 8-oxo-7,8-dihydro- 2'-deoxyguanosine: an isotope based method to evaluate artefactual oxidation of DNA during its extraction and subsequent work-up. Carcinogenesis 23, 1911-8.