Biomarqueurs de génotoxicité en lien avec l’exposition aux HAP chez les femmes ménopausées de la région de Québec
P. Ayotte(1,2), K. Al-Sabti(2), A. Laidaoui(1), N. Ouellet(1), M. Sinotte(3), J. Brisson(3), S. Bérubé(3), D. Pereg(1), É. Dewailly(1)
(1) Unité de recherche en santé publique, Centre de recherche du Centre Hospitalier Universitaire de Québec, CHUL, Québec, QC, Canada G1V 2M2. (2) Laboratoire des biomarqueurs, Direction de la toxicologie humaine, Institut national de santé publique du Québec, Québec, QC, Canada G1V 5B3. (3) Unité de recherche en santé des populations (URESP), Centre Hospitalier Affilié Universitaire de Québec
Introduction
Les hydrocarbures aromatiques polycycliques (HAP) sont des contaminants environnementaux ubiquitaires qui lorsque bioactivés se lient à l’ADN et ainsi peuvent initier la carcinogenèse (Xue et Warshaw sky, 2005). Des chercheurs ayant réalisé une étude cas-témoins sur le cancer du sein dans la région de Long-Island (New York) ont rapporté une association entre les niveaux d’adduits HAP-ADN mesurés dans les lymphocytes des participantes et le risque de cancer du sein (Gammon et al., 2002). Le rapport de cotes pour le cancer du sein chez les femmes appartenant au plus haut quintile de niveaux d’adduits comparativement aux femmes du premier quintile était de 1,51 (intervalle de confiance à 95 % = 1,04-2,20). Les mêmes auteurs ont procédé à une deuxième analyse de leurs données impliquant cette fois un plus grand nombre de cas et de témoins chez qui les adduits HAP-ADN avaient été mesurés (Gammon et al., 2004). Les résultats confirmaient dans une certaine mesure ceux publiés précédemment mais l’augmentation du risque était plus faible (29 % plus élevé chez les femmes montrant des niveaux détectables d’adduits versus celles chez qui des adduits n’avaient pas été détectés) et il n’y avait pas d’évidence d’une relation dose-réponse entre les quantiles. Par ailleurs, la consommation de viandes grillées ou fumées, laquelle est une source d’exposition aux HAP et aux amines hétérocycliques, a été associée au risque de cancer du sein dans cette même étude (Steck et al., 2007).
Nous avons réalisé une étude pilote parmi 110 femmes ménopausées de la région de Québec, en bonne santé, afin d’examiner les relations entre l’exposition aux HAP par la consommation de viandes grillées/ fumées, les adduits HAP-ADN et différents marqueurs de génotoxicité.
Matériels et méthodes
Sujets
Les participantes ont été recrutées lors de leur visite à une clinique de dépistage du cancer du sein desservant la grande région de Québec. Elles ont répondu à un court questionnaire visant notamment à documenter leur consommation de viandes grillées et fumées et ont donné un échantillon de sang pour l’analyse de différents marqueurs de génotoxicité.
Isolement des lymphocytes et cryopréservation
Le sang prélevé sur EDTA a été centrifugé puis la couche de cellules blanches a été recueillie. Les lymphocytes ont été isolés par centrifugation dans un gradient de Ficoll-Hypaque, lavés, suspendus dans un milieu de cryopréservation (90 % sérum bovin fétal + 10 % diméthylsulfoxyde) puis congelés dans un vase de Dewar contenant de l’azote liquide.
Test des comètes
La version alcaline du test des comètes est utilisée dans notre laboratoire pour quantifier les bris dans les brins d’ADN, selon une modification de la procédure élaborée par McNamee et al. (2002). Les paramètres des comètes ont été évalués en microscopie de fluorescence à l’aide du logiciel d’analyse d’image mis au point par Loats Associates (Westminster, MD). Cent comètes ont été évaluées par sujet.
Adduits BPDE-ADN
Nous avons utilisé l’immunoessai compétitif par chimiluminescence développé par Divi et al. (2002), dans lequel un antisérum contre de l’ADN modifié par le (±)-7β,8α- dihydroxy-9α,10α-époxy- 7,8,9,10-tétrahydrobenzo[a]- pyrène (BPDE) permet de quantifier les adduits BPDE-ADN dans l’ADN lymphocytaire.
Aberrations chromosomiques
Le sang frais prélevé sur héparine est utilisé pour démarrer des cultures de lymphocytes en présence de l’agent mitogène phytohémaglutinine. Après 48 heures, on ajoute de la colcémide aux cultures puis deux heures plus tard, les cellules sont lysées et fixées au Carnoy. La suspension résultante est déposée sur des lames, séchée puis colorée au Giemsa. Un minimum de 100 métaphases sont analysées au microscope pour chaque participante.
Test des micronoyaux
La procédure de Fenech et Morley (1985) a été utilisée. Les cultures de lymphocytes sont démarrées comme ci-dessus et après 44 heures, de la cytochalasine B est ajoutée puis une autre période d’incubation de 28 heures suit. À la fin de cette période, les cellules sont lysées et fixées au Carnoy. La suspension résultante est déposée sur des lames, séchée puis colorée au Giemsa. Seules les cellules binuclées qui sont isolées des cellules avoisinantes sont évaluées et les micronoyaux ne sont comptés que s’ils sont distincts des deux noyaux. Mille cellules binuclées sont évaluées pour chaque sujet.
Délétion GSTM1
Nous avons développé un test utilisant des amorces spécifiques au gène GSTM1 fonctionnel (5’-ATGATCTGCTACAATCCA GAA-3’ et 5’-GCCCCAGGAGC GCCCAAG-3’) qui génèrent un produit de 695 paires de bases. Des amorces visant un autre locus chromosomique ont été utilisées pour vérifier que l’ADN pouvait être amplifié (produit de 305 paires de bases). Les produits d’amplification ont été séparés sur un gel d’agarose 1 % et les génotypes assignés par deux évaluateurs indépendants.
Résultats
L’âge moyen des 110 femmes de notre étude est 58,3 ans (gamme = 48 – 76 ans). La moyenne de leur indice de masse corporelle était de 27,0 kg/m2 (gamme = 17,2 – 51,3 kg/m2). Seulement 7 % d’entre elles fumaient au moment de leur recrutement, bien que la moitié aient déjà fumé au cours de leur vie. Leur consommation moyenne de viandes grillées étaient de 25,2 g/ jour (gamme = 0 - 110,0 g/jour).
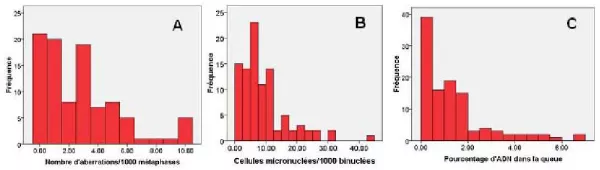
Les niveaux d’adduits HAP-ADN étaient inférieurs à la limite de détection de la méthode (5 adduits par 109 nucléotides) chez toutes les participantes. La figure 1 présente les distributions de fréquence des aberrations chromosomiques, des cellules micronuclées et du pourcentage d’ADN dans les queues des comètes. Le nombre de cellules micronuclées était corrélé au nombre d’aberrations chromosomiques chez les participantes (r de Spearman = 0,707, p < 0,001).
Figure 1. Distribution de fréquences des marqueurs de génotoxicité chez 96 femmes ménopausées de la région de Québec : aberrations chromosomiques (A), test des micronoyaux sur cellules binuclées (B) et test des comètes (C).
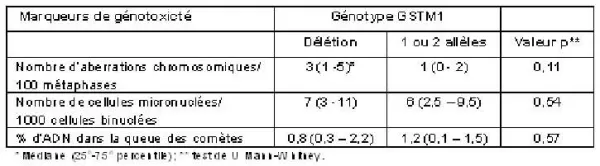
La consommation de viandes grillées chez ces femmes n’était pas reliée aux mesures de dommage génétique. Les femmes ayant la délétion GSTM1 montraient davantage d’aberrations chromosomiques que celles avec au moins un allèle GSTM1 (tableau 1), mais cette différence n’était pas statistiquement significative (p = 0,11).
Tableau 1. Marqueurs de génotoxicité en fonction du génotype GSTM1 chez 96 femmes ménopausées de la région de Québec.
Conclusion
Dans ce groupe de femmes en bonne santé, l’exposition aux HAP par l’alimentation semble insuffisante pour induire une quantité d’adduits HAP-ADN détectable ou un quelconque dommage génétique. Nous évaluons présentement le rôle de la capacité de réparation de l’ADN comme facteur prédisposant au dommage génétique dans ce groupe.
Bibliographie
- Divi, R.L., Beland, F.A., Fu, P.P., Von Tungeln, L.S., Schoket, B., Camara, J.E., Ghei, M., Rothman, N., Sinha, R., and Poirier, M.C. (2002). Highly sensitive chemiluminescence immunoassay for benzo[a]pyrene-DNA adducts: validation by comparison with other methods, and use in human biomonitoring. Carcinogenesis 23, 2043-2049.
- Fenech, M., and Morley, A.A. (1985). Measurement of micronuclei in lymphocytes. Mutat. Res. 147, 29-36.
- Gammon, M.D., Santella, R.M., Neugut, A.I., Eng, S.M., Teitelbaum, S.L., Paykin, A., Levin, B., Terry, M.B., Young, T.L., Wang, L.W., et al.. (2002). Environmental toxins and breast cancer on Long Island. I. Polycyclic aromatic hydrocarbon DNA adducts. Cancer Epidemiol. Biomarkers Prev. 11, 677-685.
- Gammon, M.D., Sagiv, S.K., Eng, S.M., Shantakumar, S., Gaudet, M.M., Teitelbaum, S.L., Britton, J.A., Terry, M.B., Wang, L.W., Wang, Q., et al. (2004). Polycyclic aromatic hydrocarbon- DNA adducts and breast cancer: a pooled analysis. Arch. Environ. Health 59, 640-649.
- McNamee, J.P., Bellier, P.V., Gajda, G.B., Miller, S.M., Lemay, E.P., Lavallee, B.F., Marro, L., and Thansandote, A. (2002). DNA damage and micronucleus induction in human leukocytes after acute in vitro exposure to a 1.9 GHz continuous-wave radiofrequency field. Radiat. Res. 158, 523- 533.
- Steck S.E., Gaudet M.M., Eng S.M., Britton J.A., Teitelbaum S.L., Neugut A.I., Santella R.M., Gammon M.D. (2007). Cooked meat and risk of breast cancer—lifetime versus recent dietary intake. Epidemiology 18(3), 373-82.
- Xue W., and Warshawsky, D. (2005). Metabolic activation of polycyclic and heterocyclic aromatic hydrocarbons and DNA damage: a review. Toxicol. Appl. Pharmacol. 206, 73-93.