Intoxication sévère avec un bloqueur du canal calcique (BCC)
Volume 26, Numéro 3
Collaborateurs : Pierre-André Dubé (B. Pharm. M. Sc., Pharmacien, INSPQ), Simon Berthelot (M.D., FRCP, CHUQ), Michel Normand (M.D., FRCP, CHUQ).
Révision scientifique: René Blais (M.D., FRCP(C), ABMT, Directeur médical, Centre antipoison du Québec).
Introduction
Le nombre d’intoxications par les bloqueurs du canal calcique (BCC) au Québec est passé d’une centaine de cas rapportés en 1991 à 359 en 2009. Depuis 1991, selon le Centre antipoison du Québec (CAPQ), plus de 60 % de ces intoxications ont nécessité des soins médicaux en milieu hospitalier et 30 patients en sont décédés (1). Une récente étude rétrospective québécoise effectuée dans les régions de Montréal et de Québec (n = 103) a identifié une mortalité de 6 % et une morbidité de 49 % (insuffisance rénale aigüe; 45 %, acidose métabolique; 36 %, oedème pulmonaire; 22 %) chez tous les patients s’étant présentés à l’urgence avec une histoire d’ingestion potentiel-lement toxique d’un BCC (2). La prise en charge de tels patients est souvent complexe, d’autant plus qu’elle implique des traitements pouvant être perçus comme peu conventionnels.
Le présent article fait état d’un cas d’intoxication sévère avec un BCC ayant notamment nécessité des doses importantes d’insuline avec des apports minimes de dextrose et au cours duquel l’émulsion lipidique a été utilisée. Les événements seront par la suite analysés en fonction des données actuelles de la littérature.
Description du cas
Il s’agit d’une femme de 47 ans (57 kg), prenant sur une base régulière la médi-cation suivante : venlafaxine (dépression majeure); lévothyroxine (hypothyroïdie); naproxène, oxycodone et orphénadrine (douleurs chroniques); ainsi que du vérapamil longue action (arythmies), à raison de 180 mg deux fois par jour. La patiente boit environ trois consommations d’alcool par jour, ne fume pas et ne consomme pas de drogues.
Un matin, son conjoint la retrouve inconsciente avec le flacon de vérapamil vide à ses côtés. La quantité maximale estimée pouvant avoir été ingérée par la patiente est d’environ 180 comprimés de 180 mg, soit un total de 32,4 g. Les soins médicaux d’urgence sont alors contactés par le conjoint.
À son arrivée à l’urgence à 7h10, la patiente est en choc avec une fréquence cardiaque (FC) à 42 bpm (jonctionnelle) et une pression artérielle (PA) systolique à 44 mmHg. L’électrocardiogramme initial ne met en évidence aucune autre anomalie et l’intervalle QTc est à 346 msec. Sa glycémie initiale est à 19,8 mmol/L. Elle est somnolente (Glasgow 12/15), mais protège ses voies respiratoires. Elle respire à 20/min et sature à 96 % à l’air ambiant. Après avoir installé deux voies intraveineuses périphériques et administré environ 1,5 L de salin normal, la patiente demeure en choc. Deux doses de 1 mg de glucagon sont données à cinq minutes d’intervalle, sans succès, suivies huit minutes plus tard de 1 mg d’atropine sans plus de résultats. À 7h20, soit 20 minutes après l’arrivée de la patiente, un bolus de dix unités d’insuline régulière et une ampoule de 50 ml de dextrose 50 % sont administrés, suivis 15 minutes plus tard d’un deuxième bolus de 40 unités d’insuline régulière. Une perfusion de norépinephrine (4 mg/250 ml) est débutée, puis augmentée jusqu’à 60 ml/h sur une vingtaine de minutes. Pendant ce temps, une deuxième dose d’atropine de 1 mg, une dose de glucagon de 2 mg, deux doses de 1 g de gluconate de calcium et 50 mmol de bicarbonates sont administrées avec peu de succès. Un cardiostimulateur externe est installé sans être mis en fonction considérant le peu de marge de manoeuvre disponible pour la sédation. La FC demeure à 42 bpm, mais la PA s’élève à 75/37 mmHg.
La perfusion de norépinephrine est par la suite augmentée jusqu’à 80 ml/h, puis la dopamine (200 mg/250 ml) est ajoutée à 8h14. Les deux médicaments sont progressivement titrés à la hausse, soit jusqu’à 100 ml/h de norépinephrine ainsi que 20 ml/h de dopamine. À 8h25, un bolus de 70 ml d’émulsion lipidique 20 % puis une perfusion sont donnés sans succès avec un troisième bolus de salin normal, car la PA a progressivement diminué à 57/28 mmHg alors que la FC demeure à 41 bpm. Malgré l’augmentation des doses d’amines jusqu’à 120 ml/h pour la norépinephrine et 50 ml/h pour la dopamine, l’hypotension et la bradycardie persistent. Elle reçoit alors deux doses d’épinéphrine IV (1/10 000; 0,1 mg), 2 g gluconate de calcium à trois reprises, deux bolus de 5 mg de glucagon puis une perfusion d’insuline régulière(100 unités/100 ml) est débutée à 50 ml/h soit un peu moins de 1 unité/kg/h.
L’installation d’une voie centrale fémorale est tentée sans succès. Par la suite, la PA augmente jusqu’à 80/38 mmHg, mais la bradycardie a progressé jusqu’à 29 bpm. La glycémie demeure à 14,7 mmol/L.
Une perfusion d’épinéphrine (1 mg/250 ml) à 25 ml/h est alors débutée. Après une première tentative d’intubation infructueuse avec 2 mg de midazolam, puis une deuxième avec 10 mg d’étomidate et 80 mg de succinylcholine, elle est intubée avec succès à 9h50 sous rocuronium 5 mg et succinylcholine 120 mg. Il est à noter que la patiente n’a probablement pas reçu la médication administrée aux deux premières tentatives puisque la voie périphérique semblait infiltrée.
Après l’intubation, la perfusion d’épinéphrine est augmentée jusqu’à 100 ml/h, mais la FC demeure à 30 bpm et la PA à 78/42 mmHg. Une voie centrale jugulaire est installée avec succès. Un peu après 9 h 50, une perfusion de glucagon (5 mg/50 ml à 50 ml/h) est débutée sans changement hémodynamique apparent. À 10 h 35, un cardiostimulateur endoveineux programmé à 70 bpm est finalement mis en place et la PA s’améliore à 120/60 mmHg. En parallèle, la perfusion d’insuline est aussi augmentée jusqu’à 500 U/h. La figure 1 montre l’hémodynamie en fonction des traitements tentés pendant la phase de stabilisation de la patiente.
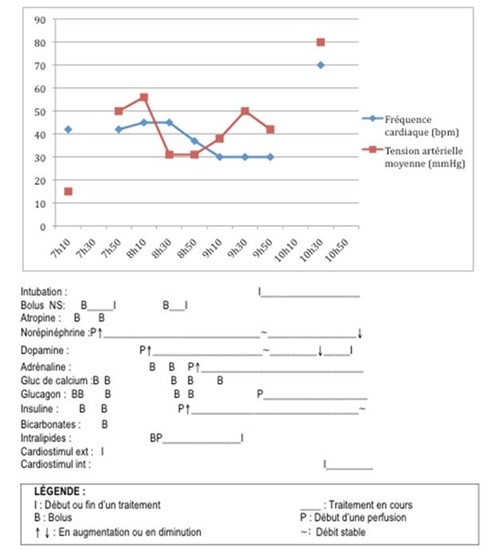
La patiente est admise à l’unité coronarienne avec un suivi des glycémies, initialement aux heures puis aux 30 minutes en soirée. Les perfusions sont alors :
- Glucagon 5 mg/h;
- Insuline rapide à 500 U/h;
- Épinéphrine (4 μg/ml) à 120 ml/h;
- Norépinephrine (4 mg/250 ml) en diminution progressive puis cessée à 12h10;
- Propofol (10 mg/ml) à 10 ml/h (débuté à l’arrivée à l’unité coronarienne);
- Salin normal à 150 ml/h.
Moins de deux heures après son installation, le cardiostimulateur est devenu inutile, la FC étant à 78 bpm et la PA à 94/53 mmHg. Malgré la dose massive d’insuline que la patiente reçoit, ses glycémies demeurent supérieures à 25 mmol/L, bien que tous les apports de dextrose aient été cessés. Vers 15h20, la perfusion d’insuline est diminuée à 100 U/h, sans impact au niveau hémodynamique. Le propofol doit être cessé vers 17h à cause d’un problème d’hypotension. Des perfusions de midazolam (1 mg/ml à 3 ml/h) et de fentanyl (25 μg/ml à 3 ml/h) sont débutées, résultant en une meilleure stabilité de la PA.
Les prélèvements faits à l’arrivée démontrent une concentration sanguine d’acétaminophène < 5 umol/L, une salicylémie à 0,1 mmol/L, une formule sanguine normale, des bilans hépatique et cardiaque sans particularité avec quelques anomalies biochimiques. Par contre, les bilans effectués à 12h20 mettent en évidence une acidose métabolique avec trou anionique augmenté, une hyperlactatémie (9,5 mmol/L), une insuffisance rénale aigüe ainsi qu’une insuffisance hépatique. À 18 h, la défaillance multisystémique a progressé, malgré les traitements comme démontré par le tableau 1.
|
Formule sanguine (GB / Hb / Plaq) |
Biochimie (Urée / Créat / Sodium / Potassium / Chlorures) |
|
|
Arrivée |
11,2 X 109/L / 136 g/L / 292 |
2,2 mmol/L / 83 umol/L / 132 mmol/L / 2,8 mmol/L / 93 mmol/L |
|
12h20 |
20,3 X 109/L / 106 g/L / 252 |
2,9 mmol/L / 92 umol/L / 122 mmol/L / 2,7 mmol/L / 89 mmol/L |
|
18h |
19,8 X 109/L / 115 g/L / 229 |
3,4 mmol/L / 95 umol/L / 114 mmol/L / 3,0 mmol/L / 83 mmol/L |
|
Gaz (pH / pCO2 / O2 / HCO3) |
Glucose / Trou anion / Osmol sérique / ÉtOH/ Trou osmol / corrigé |
|
|
Arrivée |
Veineux : 7,33 / 42 / NA / 21 |
7,3 mmol/L / 18 / 312 mOsm/kg / 30,7 mmol/L / 38 / 2 |
|
12h20 |
Artériel : 7,19 / 28 / 122 / 10 (FiO2 70 %) |
23 / (non disponible) |
|
18h |
Artériel : 7,23 / 28 / 114/ 11 (FiO2 70 %) |
33,5 mmol/L / 20 / 268 mmol/kg / (non disponible) |
|
Autres ions (Calcium / Phosphore / Magnésium / Alb) |
Bilan hépatique (Bili totale / Bili dir / Bili indir / AST / ALT / GGT / PALC) |
|
|
Arrivée |
2,17 mmol/L/ 1,23 mmol/L/ 0,75 mmol/L/ 25 |
3 umol/L/ 2 umol/L / 1 umol/L/ 21 U/L / 13 U/L/ 15 U/L/ 68 U/L |
|
12h20 |
2,18 mmol/L/ 1,15 mmol/L/ 0,50 mmol/L/ 25 |
16 umol/L/ 10 umol/L / 6 umol/L/ 247 U/L/ 126 U/L/ 60 U/L/ 46 U/L |
|
18h |
2,02 mmol/L/0,57 mmol/L/0,31 mmol/L/29 |
16 umol/L/ 6 umol/L/ 10 umol/L/ 427 U/L/ 218 U/L/ 74 U/L / 52 U/L |
|
Bilan cardiaque (CK / Troponines T) |
Coagulogramme (RNI / Temps de céphaline) |
|
|
Arrivée |
62 U/L / < 0,02 ug/L |
(non disponible) |
|
12h20 |
117 U/L / 0,06 ug/L |
1,40 / 29,4 sec |
|
18h |
530 U/L / 0,08 ug/L |
3,09 / 28,3 sec |
La perfusion de glucagon est cessée vers 21h20 considérant l’atteinte hépatique et l’utilité clinique controversée. Puisqu’une prise d’acétaminophène ne peut complètement être exclue, un protocole de N-acétylcystéine IV de 21 heures est débuté en fin de soirée. Devant l’hyponatrémie de la patiente, du NaCl 3 % à 30 ml/h pendant deux heures puis 15 ml/h pendant quatre heures est administré. Trois bolus de 10 mmol de KCl sont également donnés pendant les premières 24 heures, ainsi que du sulfate de magnésium.
Durant la nuit, la perfusion d’épinéphrine est progressivement diminuée puis cessée en avant-midi (voir ci-dessous). Les glycémies ayant diminué à 19,8 mmol/L, le dextrose est progressivement réintroduit. Au jour 2, à 7h20, les médications suivantes sont en cours :
- Perfusion d’insuline régulière à 100 U/h;
- Perfusion d’épinéphrine (4 μg/ml) à 55 ml/h;
- Perfusion de midazolam (1 mg/ml) à 3 ml/h;
- Perfusion de fentanyl (25 μg/ml) à 3 ml/h;
- Perfusion de N-acétylcystéine à 64 ml/h;
- Ampoule de dextrose 50 % suivie de dextrose 20 % à 100 ml/h.
L’insuffisance rénale est rentrée dans l’ordre et la perturbation du bilan hépatique est également en voie d’amélioration. Le rapport normalisé international (RNI) est d’ailleurs redescendu à 1,31. L’hypothèse d’une possible erreur de laboratoire est évoquée en ce qui a trait au résultat de RNI à 3,09 et la perfusion de N-acétylcystéine est cessée avant la fin du protocole de 21 h. Le sodium est remonté à 127 mmol/L, ce qui représente une correction d’environ 13 mmol/L en 12 heures. L’acidose métabolique s’améliore et les lactates sont redescendus à 2,3 mmol/L. Les perfusions de sédation sont cessées à 10h20, et la patiente est extubée quelques heures plus tard. Le cardiostimulateur endoveineux est retiré en après-midi.
L’épinéphrine est complètement cessée à 9h20 alors que la patiente a une PA à 134/71 mmHg, un rythme sinusal à 87 bpm et une glycémie capillaire en diminution progressive à 11,7 mmol/L malgré les apports de dextrose. L’insuline est également sevrée progressivement. Le tableau 2 fait état de l’évolution de la glycémie de la patiente dans le temps en fonction de son état hémodynamique.
|
Jour/Heure |
Glycémie capillaire |
Insuline |
Dextrose
|
Glucagon |
Amines |
PA |
FC |
|
J1 7h10 |
19,8 |
0 |
0 |
0 |
0 |
44/ nd |
42 |
|
J1 7h20 |
nd |
10 U |
Amp D50 % |
2 mg |
|
nd |
nd |
|
J1 7h45 |
nd |
40 U |
0 |
2 mg |
|
64/34 |
40 |
|
J1 8h45 |
14,7 |
50 U/h |
0 |
5 mg x 2 |
|
80/38 |
29 |
|
J1 9h50 |
nd |
300 U/h |
0 |
5 mg/h |
|
78/42 |
30 |
|
J1 11h20 |
21,4 |
500 U/h |
0 |
5 mg/h |
~ |
120/47 |
68 |
|
J1 15h20 |
> 27,8 |
100 U/h |
0 |
5 mg/h |
~ |
86/49 |
87 |
|
J1 18h20 |
> 27,8 |
100 U/h |
0 |
5 mg/h |
↓ |
95/52 |
87 |
|
J1 21h20 |
> 27,8 |
100 U/h |
0 |
0 |
↓ |
113/62 |
84 |
|
J2 1h20 |
19,8 |
100 U/h |
D10 % 100 ml/h |
0 |
↓ |
119/68 |
89 |
|
J2 6h20 |
19,8 |
100 U/h |
Amp D50% D20 % 100 ml/h |
0 |
↓ |
130/72 |
83 |
|
J2 8h20 |
15,1 |
88 U/h |
D20 % 100 ml/h |
0 |
↓ |
154/79 |
88 |
|
J2 9h00 |
16,2 |
44 U/h |
D20 % 50 ml/h |
0 |
↓ |
134/71 |
87 |
|
J2 9h20 |
11,7 |
44 U/h |
D20 % 100 ml/h |
0 |
0 |
117/59 |
87 |
|
J2 10h00 |
11,6 |
22 U/h |
D20 % 100 ml/h |
0 |
0 |
120/62 |
82 |
|
J2 11h25 |
9,1 |
0 |
D20 % 50 ml/h |
0 |
0 |
129/63 |
84 |
|
J2 13h20 |
3,4 |
0 |
D20 % 70 ml/h |
0 |
0 |
129/66 |
89 |
|
J2 14h00 |
3,4 |
0 |
D20 % 100 ml/h |
0 |
0 |
139/67 |
95 |
|
J2 18h00 |
5,0 |
0 |
D20 % 80 ml/h |
0 |
0 |
161/80 |
101 |
|
J2 19h20 |
3,5 |
0 |
D20 % 75 ml/h |
0 |
0 |
169/82 |
99 |
|
J2 23h20 |
4,8 |
0 |
D20 % 50 ml/h |
0 |
0 |
167/86 |
94 |
|
J3 7h20 |
6,3 |
0 |
0 |
0 |
0 |
152/81 |
107 |
L’administration de dextrose 20 % en perfusion avec des bolus de dextrose 50 % occasionnels sont nécessaires pendant les 20 heures qui suivent l’arrêt de la perfusion d’insuline.
Au cours de la deuxième nuit d’hospitalisation, la patiente développe des signes de surcharge (bilan positif d’environ 7,5 litres depuis son arrivée) qui nécessite 20 mg de furosémide ainsi qu’une diminution des apports liquidiens. Elle répond au traitement de façon remarquable et est transférée à l’étage le matin même, après qu’une échographie cardia-que ait démontré une fonction normale. Par la suite, elle avoue avoir ingéré 25 comprimés de vérapamil (4,5 g total) avec un litre de vin et une bière durant la soirée précédant son hospitalisation. La patiente a congé une semaine après son admission.
Il est à noter que la patiente a souffert d’une nécrose cutanée à la suite de l’infiltration de la dose initiale d’épinéphrine. L’infiltration locale avec de la phentolamine environ quatre heures plus tard n’a pas permis d’éviter une nécrose cutanée qui nécessitera peut-être une greffe.
Analyse
La prise en charge actuellement suggérée par le CAPQ est basée sur les écrits de De Witt et Waksman(3) à quelques nuances près. Cet algorithme a principalement été construit à partir de la physiopathologie de cette intoxication, des mécanismes d’action des BCC, ainsi que des modalités thérapeutiques décrites dans la littérature.
La plupart des auteurs proposent d’initier des mesures de soutien à l’aide d’un remplissage liquidien prudent, d’amines et d’atropine au besoin. L’amélioration serait cependant temporaire et ne corrigerait en rien la toxicité des BCC (4, 5). Ces mêmes auteurs suggèrent que l’administration de calcium permettrait le passage plus aisé des molécules par les canaux non bloqués. Des études animales auraient démontré que le calcium intraveineux corrige l’hypotension en améliorant le débit cardiaque (6). Les résultats sont cependant mitigés, sans compter le risque de complications associées à l’hypercalcémie potentiellement induite par le traitement (7). Il n’est donc pas surprenant que les bolus administrés dans le cas décrit précédemment n’aient pas entrainé d’amélioration clinique.
En ce qui a trait au glucagon, il stimulerait la gluconéogénèse hépatique et l’adénylcyclase, améliorant ainsi la formation d’AMPc par d’autres récepteurs que les canaux calciques. Bailey affirme sur la base d’études animales que le glucagon augmenterait la fréquence et le débit cardiaques, et renverserait au moins transitoirement des blocs auriculo-ventriculaires de haut degré sans toutefois avoir d’impact sur la survie (8). D’autres études soulignent que l’hyperglycémie engendrée par un tel traitement pourrait être délétère (9). Il est difficile de départager, dans le cas présent, quelle proportion de l’hyperglycémie de la patiente était due au glucagon ou au BCC, puisqu’il existe une corrélation entre l’hyperglycémie et la sévérité de l’intoxication (10). Il demeure que le phénomène a persisté plusieurs heures après l’arrêt de la perfusion, alors que la demi-vie du glucagon n’est que de quelques minutes. De plus, il est probable que la perturbation hépatique en situation de choc ne permette pas une gluconéogénèse efficace avec le glucagon. Devant la controverse entourant l’administration de ce médicament lors de l’intoxication par les BCC et le peu d’amélioration clinique observée après son utilisation pour le cas présent, il apparaît raisonnable de cesser la perfusion et les bolus.
L’administration de fortes doses d’insuline, en préservant la glycémie, permettrait au myocarde d’utiliser le glucose comme source d’énergie de manière plus efficace (4, 5). L’insuline en elle-même a un effet inotrope tout en augmentant le débit coronarien et l’apport d’oxygène aux cellules myocardiques (11, 12). Des rapports de cas, ainsi que des études animales, semblent démontrer l’efficacité de ce traitement, notamment en permettant de sevrer les patients plus rapidement des amines (13). Il est à noter que la détérioration de l’hémodynamie après le retrait du traitement a même été observée par Megarbane et collab. (14). Les doses recommandées varient beaucoup d’une étude à l’autre, mais tendent à suggérer de commencer précocement ce traitement dont les effets peuvent se manifester seulement 30 à 60 minutes après son initiation. Les recommandations actuelles du CAPQ sont d’administrer un bolus d’insuline de 1 U/kg avec 25 à 50 ml de dextrose 50 %; suivi d’une perfusion d’insuline de 1 U/kg/h accompagnée d’une perfusion de dextrose de 0,5 g/kg/h. Pour le présent cas, l’hyperglycémie était tellement élevée que de plus faibles doses de dextrose ont été nécessaires. L’utilisation initiale du cardiostimulateur endoveineux n’a été requis que temporairement, et le sevrage des amines a été possible une fois l’insuline introduite. Cela va dans le même sens que les études précitées démontrant l’efficacité de ce traitement.
La milrinone, un inhibiteur de la phosphodiestérase III, améliore la contractilité myocardique en diminuant la destruction de l’AMPc, en plus de posséder des propriétés vasodilatatrices importantes. Considérant l’hypotension présentée par la patiente, son utilisation semblait risquée. Cette opinion est d’ailleurs partagée par plusieurs médecins qui ont été confrontés à cette étape de la prise en charge des intoxications par les BCC (15). Quant au cardiostimulateur endoveineux, il n’a été nécessaire que pour une courte période, ce qui est souvent le cas. Il s’avère même souvent sans effet sur la pression artérielle en raison du déficit de contractilité persistant malgré une conduction myocardique rétablie (4). La prochaine étape aurait sans doute été la circulation extracorporelle qui n’a pas encore été tentée à ce jour dans un tel contexte au Québec. Bien que Mégarbane et collab. (16) utilisent cette technique sur une base régulière pour les intoxications par les cardiotoxiques, elle n’est pas sans complications et comporte un risque significatif d’embolie, d’hémorragie ou d’ischémie d’un membre (17). Le CAPQ suggère actuellement d’être disposé à offrir rapidement cette dernière option en cas de collapsus cardiovasculaire résistant aux autres modalités thérapeutiques.
L’administration infructueuse de l’émulsion lipidique soulève un questionnement intéressant. Actuellement, cette option est acceptée dans la littérature comme mesure héroïque, après que les autres modalités thérapeutiques aient échoué ou lors d’une asystolie provoquée par une intoxication par un BCC (18). Premièrement, l’émulsion lipidique fournirait un compartiment supplémentaire où un BCC comme le vérapamil, considérant ses propriétés lipophiles, peut se loger. Deuxièmement, l’administration d’acides gras préviendrait le passage du métabolisme des lipides aux glucides. Troisièmement, l’émulsion lipidique activerait directement les canaux calciques du myocarde en induisant une augmentation de l’influx proportionnelle à la dose (19). Une revue systématique effectuée par une équipe de chercheurs québécois a identifié certaines évidences basées sur des études de faible qualité méthodologique en faveur de l’émulsion lipidique en cas d’intoxication par le vérapamil (20). La thrombophlébite superficielle, l’allergie croisée avec les oeufs et le soya, l’embolie graisseuse, l’augmentation de l’absorption du toxique liposoluble par le tube digestif, les complications vasculaires et la diminution d’efficacité des autres médicaments ont été à ce jour identifiés comme effets indésirables potentiels. Ces derniers relèvent pour le moment de la théorie puisqu’aucun rapport de cas ne mentionne ces effets. Par ailleurs, l’élévation du RNI lors de l’administration d’émulsion lipidique lors de l’alimentation parentérale est reconnue. Duerksen et Papineau identifient une incidence de 3,6 % chez leurs patients hospitalisés (21). Il y a donc lieu de se demander si le RNI à 3,09 était en fait un effet secondaire de l’émulsion lipidique plutôt qu’un signe d’atteinte hépatique.
Discussion
Devant une intoxication aussi morbide et mortelle que celle par les BCC, il serait justifié de soulever plusieurs questionnements en ce qui a trait à la pertinence et l’efficacité de plusieurs interventions. Tout d’abord, les signes hémodynamiques et la glycémie initiale devraient rapidement orienter le médecin par rapport à l’intensité des traitements qu’il devra initier. Il devrait si possible recourir à l’assistance d’une autre personne afin d’installer une voie centrale dès que possible pour éviter les complications et faciliter la prise en charge du patient. Les mesures de soutien ne devraient être qu’une solution temporaire avec un remplissage liquidien des plus prudents. Idéalement, une échographie cardiaque en phase aigüe permettrait d’orienter la prise en charge du patient.
Considérant la controverse entourant l’utilisation du calcium et du glucagon, leur administration dans les cas sévères avec une atteinte significative de l’hémodynamie devrait avoir pour seul objectif de maintenir les fonctions vitales en attendant le début de l’effet de l’insuline-glucose. Ce dernier traitement devrait être initié rapidement aux doses recommandées. Son application est par contre souvent erratique. Une récente étude rétrospective québécoise a démontré que l’algorithme actuel n’est suivi que pour 38,8 % des patients(2). Le cas présent semble renforcer l’efficacité de l’insuline-glucose quant à son effet sur la pression artérielle.
L’emploi des mesures mécaniques et surtout de l’émulsion lipidique comporte par contre encore beaucoup d’ambiguïtés. La patiente semble avoir bien répondu à l’installation du cardiostimulateur endoveineux qui a probablement permis d’accélérer initialement la fréquence cardiaque et de stabiliser son état pendant que l’insuline-glucose commençait à agir. Son efficacité est cependant imprévisible. En ce qui concerne l’émulsion lipidique, elle ne semble certes pas avoir aidé à la stabilisation de la patiente dans le présent cas et ses effets négatifs sur les modalités thérapeutiques subséquentes sont inconnus. Il est également pertinent de se questionner en ce qui a trait à la contribution de l’émulsion lipidique à l’élévation du RNI.
Conclusion
Bien que l’évolution de la patiente ait été favorable au prix d’efforts remarquables de l’équipe traitante, l’intoxication par les BCC confronte une fois de plus le corps médical à une double problématique. Premièrement, il existe un besoin significatif de faire avancer les connaissances en toxicologie afin que les interventions puissent être de plus en plus efficaces tout en étant basées sur les évidences scientifiques. Deuxièmement, la toxicologie est particulièrement sensible aux enjeux entourant un transfert efficace des connaissances, surtout lorsque les recommandations des centres antipoison ne correspondent pas à des gestes fréquemment posés par les équipes traitantes. Un important travail de sensibilisation reste à faire afin d’inciter les médecins à utiliser le protocole d’insuline-glucose précocement.
Pour toute correspondance
Maude St-OngeCentre antipoison du Québec
Pavillon Jeffery-Hale, 4e étage
1270, chemin Sainte-Foy
Québec (Québec) G1S 2M4
Courriel : [email protected]
Références
- Lefebvre L. Insuline / glucose dans le traitement de l'intoxication par les bloqueurs du canal calcique. Bulletin d'information toxicologique 2007;23(1):1-5. [En ligne] http://www.inspq.qc.ca/pdf/bulletins/toxicologie/InformationToxicologique_23_1.pdf
- St-Onge, Lacasse, Blais, Lesage, Guimont, Audette-Côté. Analysis of the interventions carried out in cases of voluntary or accidental calcium channel blocker poisoning in adults in the Quebec city and Montreal Island regions [abstract]. CJEM 2009;11(3):290.
- DeWitt CR, Waksman JC. Pharmacology, pathophysiology and management of calcium channel blocker and beta-blocker toxicity. Toxicol Rev 2004;23(4):223-38.
- Kerns W. Management of beta-adrenergic blocker and calcium channel antagonist toxicity. Emerg Med Clin North Am 2007 May;25(2):309-31.
- Shepherd G. Treatment of poisoning caused by beta-adrenergic and calcium-channel blockers. Am J Health Syst Pharm 2006 Oct 1;63(19):1828-35.
- Anderson AC. Calcium-Channel Blocker Overdose. Clin Pediatr Emerg Med 2005;6(2):109-15.
- Sim MT, Stevenson FT. A fatal case of iatrogenic hypercalcemia after calcium channel blocker overdose. J Med Toxicol 2008 Mar;4(1):25-9.
- Bailey B. Glucagon in beta-blocker and calcium channel blocker overdoses: a systematic review. J Toxicol Clin Toxicol 2003;41(5):595-602.
- Thomas SH, Stone CK, May WA. Exacerbation of verapamil-induced hyperglycemia with glucagon. Am J Emerg Med 1995 Jan;13(1):27-9.
- Levine M, Boyer EW, Pozner CN, Geib AJ, Thomsen T, Mick N, Thomas SH. Assessment of hyperglycemia after calcium channel blocker overdoses involving diltiazem or verapamil. Crit Care Med 2007 Sep;35(9):2071-5.
- Kline JA, Leonova E, Raymond RM. Beneficial myocardial metabolic effects of insulin during verapamil toxicity in the anesthetized canine. Crit Care Med 1995 Jul;23(7):1251-63.
- Patel NP, Pugh ME, Goldberg S, Eiger G. Hyperinsulinemic euglycemia therapy for verapamil poisoning: a review. Am J Crit Care 2007 Sep;16(5):498-503.
- Shepherd G, Klein-Schwartz W. High-dose insulin therapy for calcium-channel blocker overdose. Ann Pharmacother 2005 May;39(5):923-30.
- Megarbane B, Karyo S, Baud FJ. The role of insulin and glucose (hyperinsulinaemia/euglycaemia) therapy in acute calcium channel antagonist and beta-blocker poisoning. Toxicol Rev 2004;23(4):215-22.
- Salhanick SD, Shannon MW. Management of calcium channel antagonist overdose. Drug Saf 2003;26(2):65-79.
- Megarbane B, Deye N, Baud FJ. [Extracorporeal life support for poisonings with cardiotoxicants]. Rev Prat 2008 Apr 30;58(8):855-60.
- Ashrafian H, Athanasiou T. Extracorporeal life support for severe drug-induced cardiotoxicity: a promising therapeutic choice. Crit Care 2009;13(5):187.
- Bailey B, Blais R, Gaudreault P, Gosselin S, Laliberté M. Les antidotes en toxicologie d'urgence. 3 ed. Centre antipoison du Québec; 2009.
- Gueret G, Pennec JP, Arvieux CC. Hemodynamic effects of intralipid after verapamil intoxication may be due to a direct effect of fatty acids on myocardial calcium channels. Acad Emerg Med 2007 Aug;14(8):761.
- Jamaty C, Bailey B, Larocque A, Notebaert E, Sanogo K, Chauny JM. Lipid emulsions in the treatment of acute poisoning: a systematic review of human and animal studies. Clin Toxicol (Phila) 2010 Jan;48(1):1-27.
- Duerksen DR, Papineau N. The prevalence of coagulation abnormalities in hospitalized patients receiving lipid-based parenteral nutrition. JPEN J Parenter Enteral Nutr 2004 Jan;28(1):30-3.
St-Onge M. Intoxication sévère avec un bloqueur du canal calcique (BCC). Bulletin d'information toxicologique 2010;26(3):3-9. [En ligne] https://www.inspq.qc.ca/toxicologie-clinique/intoxication-severe-avec-u…
Bulletin d'information toxicologique, Volume 26, Numéro 3, octobre 2010
La reproduction du contenu du Bulletin d’information toxicologique est autorisée à condition d'en mentionner la source. Toute utilisation à des fins commerciales ou publicitaires est cependant strictement interdite. Les articles publiés dans ce bulletin n'engagent que la responsabilité de leurs auteurs et non celle de l'INSPQ ou du CAPQ.
ISSN : 1927-0801

