Intoxication à l’acétaminophène : sujet complexe
Volume 27, Numéro 1
Introduction
Chaque année, le Centre antipoison du Québec (CAPQ) reçoit autour de 4 000 appels pour des ingestions d’acétaminophène (paracétamol, APAP). Dans bon nombre de cas, l’heure de l’ingestion est connue et on réussit à prévenir l’atteinte hépatique en utilisant le nomogramme de Rumack-Matthew pour l’interprétation du résultat de dosage sanguin et en commençant au besoin le traitement avec la N-acétylcystéine (NAC) moins de 8 heures après l’ingestion(1,2). Il existe malheureusement des situations où le nomogramme sera inutile, voire dangereux, et d’autres où la NAC sera utilisée de façon sous-optimale. De plus, le protocole de NAC est relativement compliqué, ce qui favorise les erreurs(3-6). Le présent article a pour but d’illustrer, au moyen de quelques exemples, ces deux types de situations et de tenter de suggérer des pistes de solution dans un domaine où les données probantes ne sont pas légion.
Présentation de cas – nomogramme inutile ou dangereux
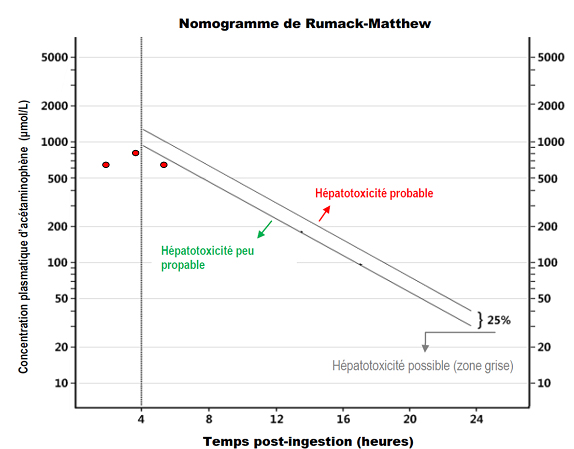
Une dame de 54 ans, sans antécédents médicaux particuliers, est évaluée au service des urgences peu après l’ingestion d’APAP, d’oxycodone et d’alcool. Les quantités sont impossibles à préciser. La patiente a des signes vitaux normaux et son oxymétrie de pouls est à 98 % à l’air ambiant; elle est somnolente. Un premier dosage d’APAP 1 h 40 min après l’ingestion est à 655 µmol/L alors qu’un deuxième, à 3 h 50 min, est à 791 µmol/L et un troisième, 2 heures plus tard, est à 691 µmol/L. Les trois dosages se trouvant dans la zone « hépatotoxicité peu probable » du nomogramme (figure 1), on lui donne congé après une évaluation psychiatrique. La dame consulte à nouveau 49 heures après l’ingestion parce qu’elle a mal à l’épigastre et qu’elle vomit. Sa fonction hépatique est fortement perturbée : AST : 17 271 UI/L; ALT : 7 175 UI/L; RNI : 6,42. Elle est hospitalisée pour hépatite toxique à l’APAP et traitée avec NAC jusqu’à ce qu’il y ait récupération significative de sa fonction hépatique.
Discussion
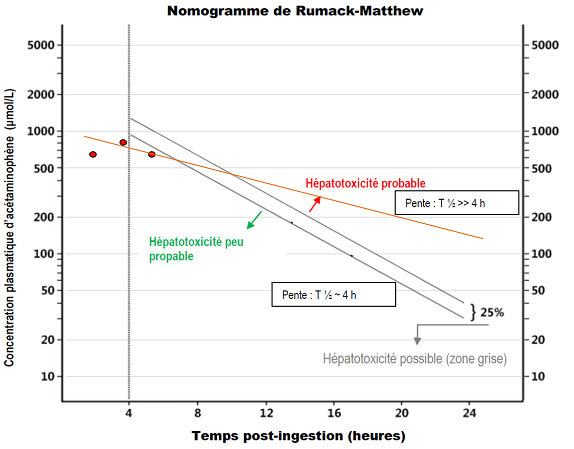
Le nomogramme de Rumack-Matthew a été conçu pour les ingestions survenant sur une période de moins de 8 heures, lorsque l’absorption est considérée terminée 4 heures après la fin de l’ingestion(3). Dans le cas décrit précédemment, il semble que l’heure de l’ingestion était assez précise, mais il est clair que l’absorption a été prolongée, probablement à cause du ralentissement du transit intestinal causé par l’oxycodone. En général, il ne faut pas se fier aveuglément au nomogramme lorsqu’on a de bonnes raisons de croire que la phase d’absorption de l’APAP sera prolongée, par exemple, lors d’ingestion concomitante d’opioïde ou d’anticholinergique, ou si la dose d’APAP ingérée est très importante(7-8). Si la concentration de l’APAP continue d’augmenter ou si la pente de la courbe d’élimination est moins abrupte que celle du nomogramme (figure 2), il y aura lieu de craindre un éventuel épuisement de la réserve hépatique de glutathion et de commencer la NAC afin de prévenir l’hépatotoxicité.
Traduction et adaptation de Rumack BH, Matthew H. Acetaminophen poisoning and toxicity. Pediatrics 1975;55(6):871–876.
D’ailleurs, en pareil cas, si le premier dosage était effectué 16 heures après l’ingestion, le résultat se situerait probablement d’emblée dans la zone d’hépatotoxicité. Il n’existe aucune ligne directrice claire quant aux concentrations sériques à partir desquelles on doit commencer l’antidote dans ce genre de situation. En plus de la concentration sérique de l’APAP et des ingestions concomitantes, il faudra tenir compte d’un ensemble de facteurs, dont les antécédents, la dose ingérée, le délai depuis l’ingestion, la qualité du péristaltisme, etc. Un professionnel du centre antipoison pourra aider à la prise de décision. En cas de doute, il est toutefois préférable d’errer dans le sens de la sécurité du patient et d’administrer l’antidote même s’il semble que le risque de réaction anaphylactoïde à la NAC soit plus important lorsque la concentration sérique d’APAP est faible(9-10).
Présentation de cas – ingestion suprathérapeutique
Un homme de 28 ans consulte sur la recommandation de son dentiste à qui il a avoué avoir consommé 1,5 g d’APAP aux 4 à 6 heures (6 à 9 g par jour) depuis 5 jours. La dernière dose remonte à 3 heures. Mis à part son mal de dent, il est asymptomatique. Les transaminases sont normales, tout comme le RNI. La concentration sérique d’APAP est à 40 µmol/L. On décide de lui administrer le protocole de 21 heures de NAC.
Discussion
Même si le patient a ingéré plus de 4 g d’APAP par jour pendant plusieurs jours, l’administration de la NAC n’était pas nécessaire dans ce cas. Selon la littérature actuelle, il faut commencer le traitement si les transaminases sont anormales ou s’il y a présence d’APAP (66 µmol/L ou plus) dans le sang. Cependant, cette dernière condition est quasi automatiquement remplie si la dernière prise d’APAP est très récente, comme dans ce cas-ci. Par conséquent, il faut interpréter le résultat du dosage en fonction de l’heure de la dernière ingestion et de la dose d’APAP ingérée. Par ailleurs, il semble que lorsqu’il y a ingestion suprathérapeutique répétée, le risque de développer une hépatotoxicité significative soit minime si le premier dosage des transaminases est normal(11).
Erreurs les plus fréquentes répertoriées par le CAPQ
Depuis plusieurs années, le traitement de l’intoxication à l’APAP avec la NAC est devenu plus compliqué, car il a été démontré qu’on pouvait améliorer le processus de récupération de la fonction hépatique en prolongeant le traitement au-delà des 21 heures traditionnelles. La nécessité de préparer 4 ou 5 perfusions ou même davantage (jusqu’à ce que le foie montre des signes de début de récupération) se traduit inévitablement par une augmentation du risque d’erreurs. Ces dernières surviendraient, selon une étude rétrospective de Hayes et collab., dans un tiers des cas(5).
- Erreur sur le moment le plus propice pour débuter le traitement : Parfois, le traitement est débuté moins de 4 heures après l’ingestion, avant même que le dosage soit effectué, car on croit que le plus tôt est le mieux. La littérature tend à démontrer que le traitement doit être commencé moins de 8 à 10 heures après l’ingestion. Par conséquent, on devra commencer l’antidote avant d’avoir le résultat du dosage uniquement si on croit que le fait d’attendre retardera le début du traitement au-delà de cette période(1).
- Vitesse d’administration : On recommande maintenant d’administrer la dose de charge de NAC en une heure plutôt qu’en 15 minutes; le risque de réaction anaphylactoïde serait alors moins important. Il semble toutefois que les principaux facteurs de risque de réaction soient l’atopie et une faible concentration sanguine d’APAP(9-10).
- Erreur de calcul des doses de NAC : Un décès est survenu au Québec il y a quelques années à la suite d’une erreur ayant conduit à l’administration de doses de NAC beaucoup trop importantes lors des 3 perfusions, ce qui a causé un status epilepticus et un œdème cérébral(12). Depuis ce temps, un logiciel a été mis au point par le CAPQ afin d’éliminer ce type d’erreur et de guider le médecin à travers les différentes étapes du traitement. Une feuille de route est transmise par télécopieur. Plusieurs centres hospitaliers ont adopté cette feuille qui suit souvent le patient pendant toute la durée du traitement.
- NAC cessée prématurément : C’est probablement l’erreur la plus fréquente. Plusieurs croient que la NAC est utile seulement lorsqu’il y a de l’APAP dans le sang. Par conséquent, ils cessent l’antidote lorsque l’APAP n’est plus détectable, ou parfois même lorsque la concentration de l’APAP redescend dans la zone « hépatotoxicité peu probable » du nomogramme. Or, la NAC sert, non seulement à la sulfatation de l’APAP, mais elle joue aussi un rôle important dans la transformation du NAPQI, métabolite hépatotoxique, en acide mercapturique, non toxique, ainsi que dans le processus de régénération du foie(1). On peut donc cesser l’antidote après la 3e perfusion si les transaminases n’ont pas augmenté et, dans le cas contraire, lorsque les transaminases sont à la baisse et le RNI normal ou amélioré de 25 % sans administration de facteurs de coagulation.
- NAC continuée inutilement : Dans un contexte d’intoxication à l’APAP, il n’est pas exceptionnel que le RNI augmente quelque peu, parfois jusqu’à 2, sans qu’il y ait élévation des transaminases. Il a été démontré que l’APAP, en surdose, peut faire augmenter le RNI à cause d’un effet sur le facteur VII fonctionnel, et ce, en absence d’hépatotoxicité(13). La NAC peut aussi influencer le RNI à la hausse en agissant sur les facteurs II, VII et X, particulièrement en début de traitement. Par conséquent, il ne faut pas considérer une légère augmentation isolée du RNI comme un signe d’hépatite fulminante(13-17).
- Délai important entre la 3e et la 4e perfusion : Il apparaît souhaitable d’entretenir une concentration sanguine de NAC relativement constante et, par conséquent, d’éviter les délais entre les perfusions. Cette situation se produit malheureusement assez souvent, surtout lorsqu’il faut prendre la décision de continuer ou non le traitement après le bilan biochimique de la 20e heure. Certains compilent dans la liste des erreurs un arrêt de NAC de plus d’une heure(5). Considérant que la demi-vie de la NAC est de 2,3 à 6,3 heures, le CAPQ recommande de recommencer le traitement à partir du début si l’arrêt a été de 4 heures ou plus. Il ne semble y avoir de données probantes sur le sujet dans la littérature.
- Décision de ne pas traiter parce que la concentration de l’APAP se situe dans la zone thérapeutique : Certains médecins se fient aveuglément aux zones thérapeutiques inscrites sur les feuilles de résultats de laboratoire. Un résultat dans la zone thérapeutique peut signifier que le patient a ingéré un gramme d’APAP il y a 2 heures, mais il faut avoir à l’esprit qu’une ingestion de 15 g il y a 18 heures pourrait donner le même résultat et nécessiter l’administration de NAC.
- Traitement avec NAC à cause d’un faux-positif d’APAP causé par une hyperbilirubinémie importante d’origine non toxique (18) : Il va sans dire qu’en pareille circonstance, il faudra faire une excellente cueillette de données. En cas de doute, il sera préférable de traiter en attendant le résultat d’un deuxième dosage effectué avec une méthode analytique différente.
- Arrêt définitif de NAC à cause d’un érythème cutané survenant au cours de la première perfusion : ce type d’effet indésirable est fréquent; il serait relié à une libération d’histamine et non à une réaction allergique typique(10). Si la réaction ne se manifeste que par un érythème (flushing), il n’y a pas lieu de modifier le traitement. Par contre, en cas de réaction urticarienne, on pourra administrer de la diphenhydramine et réévaluer la pertinence du traitement. Si toutefois il y a présence d’angioedème, de dyspnée ou d’hypotension (réaction anaphylactoïde), il faut réévaluer l’indication du traitement à la NAC et poursuivre au besoin le traitement à la même vitesse de perfusion lorsque la réaction sera terminée(19).
- Traitement de l’atteinte rénale avec la NAC en l’absence d’atteinte hépatique : Même si l’atteinte rénale survenant lors de l’intoxication à l’APAP est probablement reliée au métabolisme rénal de cette dernière, l’antidote n’a pas démontré d’efficacité pour ce type de toxicité. Cette néphrotoxicité est d’ailleurs réversible(20).
Conclusion
En conclusion, l’intoxication à l’APAP demeure une intoxication fréquente et aux innombrables facettes lorsque vient le temps de décider quand, comment et jusqu’à quand il faut traiter. Même si la littérature sur ce sujet n’est pas toujours très probante, il vaut mieux traiter les patients se situant dans une zone grise plutôt que d’avoir à gérer un cas d’hépatite fulminante. En outre, si on décide de traiter, il faut s’assurer que les doses de NAC et la vitesse d’injection soient respectées.
Pour toute correspondance
René BlaisDirecteur médical
Centre antipoison du Québec
1270, chemin Sainte-Foy, Pavillon Jeffery-Hale, 4e étage
Québec (Québec) G1S 2M4
Téléphone : 418 654-2731
Télécopieur : 418 654-2747
Courriel : [email protected]
Références
1Klein-Schwartz W et al. Intravenous acetylcysteine for the treatment of acetaminophen overdose. Expert Opin. Pharmacother 2011;12:119-30.
2Prescott LF et al: Intravenous n-acetylcysteine: the treatment of choice for paracetamol poisoning. Br Med J 1979;2:1097-1100
3Rumack B H Acetaminophen Misconceptions. Hepatology 2004;40:10–5.
4Osterhoudt KC et al: Erratum in intravenous n-acetylcysteine dosing. Ped Emerg Care 2007;23(5):354.
5Hayes BD et al: Frequency of medication errors with intravenous acetylcysteine for acetaminophen overdose. Ann Pharmacother 2008;42:766-70.
6Kao LW et al: What is the rate of adverse events after oral n-acetylcysteine administered by the intravenous route to patients with suspected acetaminophen poisoning? Ann Emerg Med 2003;42(6):741-50.
7Smith SW et al: Acetaminophen overdose with altered acetaminophen pharmacokinetics and hepatotoxicity with premature cessation of intravenous n-acetylcysteine therapy. Ann Pharmacother 2008;42:1333-9.
8Hendrickson RG et al. Bactrian (“Double Hump”) Acetaminophen Pharmacokinetics: A Case Series and Review of the Literature. J med toxicol (2010) 6:337–44.
9Schmidt LE et al: Risk factors in the development of adverse reactions to n-acetylcysteine in patients with paracetamol poisoning. Br J Clin Pharmacol 2000;51:87-91.
10Pakravan, N, et al. Risk factors and mechanisms of anaphylactoid reactions to acetylcysteine in acetaminophen overdose. Clinical Toxicology 2008;46:697-702.
11Daly F et al. Prospective Evaluation of Repeated Supratherapeutic Acetaminophen (Paracetamol) Ingestion. Ann Emerg Med. 2004;44:393-8.
12Bailey B. et al. Status epilepticus after a massive intravenous N-acetylcysteine overdose leading to intracranial hypertension and death. Ann Emerg Med. 2004;44:401-6.
13Whyte IM et al. Acetaminophen Causes an Increased International Normalized Ratio by Reducing Functional Factor VII Therapeutic Drug Monitoring 2000; 22:742–8.
14Knudsen TT et al: Effects of intravenous n-acetylcysteine infusion on haemostatic parameters in health subjects. Gut 2005;54:515-521.
15Wasserman GS et al: Intravenous administration of n-acetylcysteine: interference with coagulopathy testing. Ann Emerg Med 2004;44(5):546-547.
16Payen C. et al. Prothrombin time prolongation in paracetamol poisoning: a relevant marker of hepatic failure? Human & Experimental Toxicology 2003; 22, 617-21.
17Schmidt LE et al. Effect of acetylcysteine on prothrombin index in paracetamol poisoning without hepatocellular injury Lancet. 2002 Oct 12;360(9340):1151-2.
18Bertholf RL et al. False-Positive Acetaminophen Results in a Hyperbilirubinemic Patient Clinical Chemistry 2003;49:695-8.
19Bailey B et al. Les antidotes en toxicology d’urgence, 3e éd. N-acétylcystéine, 99-108.
20Mazer M et al. Acetaminophen-Induced Nephrotoxicity: Pathophysiology, Clinical Manifestations, and Management. J med. toxicol. 2008;4 :2-6.
21Doyon S et al: Hepatotoxicity despite early administration of intravenous N-acetylcysteine for acute acetaminophen overdose. Acad Emerg Med 2009;16(1):34-9.
Blais R. Intoxication à l'acétaminophène: sujet complexe. Bulletin d'information toxicologique 2011;27(1). [En ligne] https://www.inspq.qc.ca/toxicologie-clinique/intoxication-l-acetaminoph…
Bulletin d'information toxicologique, Volume 27, Numéro 1, janvier 2011
La reproduction du contenu du Bulletin d’information toxicologique est autorisée à condition d'en mentionner la source. Toute utilisation à des fins commerciales ou publicitaires est cependant strictement interdite. Les articles publiés dans ce bulletin n'engagent que la responsabilité de leurs auteurs et non celle de l'INSPQ ou du CAPQ.
ISSN : 1927-0801