Avis concernant l’utilisation du vaccin contre la COVID-19 Ad26.COV2.S de Johnson & Johnson
Faits saillants
- Le vaccin de Johnson & Johnson contre la COVID-19 a été autorisé par Santé Canada pour une utilisation chez des personnes âgées de 18 ans et plus.
- Ce vaccin utilise un vecteur viral (adénovirus humain de type 26) encodant la protéine de spicule du SRAS-CoV-2.
- Le vaccin peut être conservé ou transporté à une température réfrigérée comprise entre 2 et 8 °C jusqu’à la date de péremption. Il doit être administré par voie intramusculaire en une seule dose.
- Dans une étude de Phase 3, le vaccin a montré une efficacité de 67 % pour prévenir les formes modérées ou sévères de la COVID-19, de 77 % contre les formes graves et aucun décès n’est survenu dans le groupe ayant reçu le vaccin de Johnson & Johnson.
- Les données issues de l’essai clinique de phase 3 montrent un profil de réactogénicité comparable à celui des autres vaccins contre la COVID-19.
- À ce jour, 15 cas de thrombocytopénie thrombotique immunitaire induite par le vaccin (TTIV) ont été rapportés suite à l’administration de ce vaccin aux États-Unis (environ 8 millions de doses administrées), tous chez des femmes âgées entre 18 et 59 ans.
- L’analyse des risques et bénéfices associés à une vaccination, dans la situation épidémiologique actuelle, et en prenant un horizon de 4 semaines pour les bénéfices en termes d’admissions en soins intensifs prévenues ne montre pas un profil clairement favorable pour les femmes âgées de moins de 60 ans ni pour les hommes âgés de moins de 30 ans.
- L’acceptabilité de ce vaccin pourrait être inférieure aux vaccins à ARN messager (ARNm).
- La haute sécurité et efficacité des vaccins à ARNm font que ce type de produit devrait être offert de manière préférentielle à tous les individus qui appartiennent aux groupes pour lesquels ils sont autorisés et qui ne présentent pas de contre-indication.
- Le vaccin de Johnson & Johnson est recommandé pour les personnes de 18 ans et plus qui présentent une contre-indication à l’utilisation d’un vaccin à ARNm.
- Le vaccin de Johnson & Johnson pourrait être offert aux femmes âgées de 60 ans ou plus ou aux hommes âgés de 30 ans et plus qui veulent se prévaloir d’un calendrier vaccinal ne comportant qu’une seule dose ou ne veulent pas attendre pour recevoir un vaccin à ARNm.
- L’utilisation du vaccin de Johnson & Johnson pourrait être envisagée pour des personnes âgées de 18 ans et plus dans des circonstances exceptionnelles, lorsque les conditions de stockage et de transport rendraient quasiment impossible l’utilisation d’un vaccin à ARNm ou lorsqu’il serait hautement probable que l’individu ne se représente pas pour recevoir une deuxième dose de vaccin afin de compléter son calendrier.
- Dans tous les cas, l’offre du vaccin de Johnson & Johnson devrait s’accompagner d’une information complète sur les avantages, les risques et les inconvénients de ce vaccin et des autres.
- Les professionnels de la santé devraient être à l’affût de symptômes qui pourraient indiquer une thrombose avec thrombocytopénie (TTIV) chez les personnes vaccinées récemment avec ce produit, et suivre les lignes directrices applicables, le cas échéant.
Contexte
Le vaccin Ad26.COV2.S a été développé par la société Janssen en Europe, une filiale de Johnson & Johnson. Ce produit appelé vaccin de Johnson & Johnson contre la COVID-19 a été autorisé par Santé Canada le 5 mars 2021 pour une utilisation chez des personnes âgées de 18 ans et plus. Ce court avis est basé sur les études publiées, les informations transmises par le fabricant en vue de l’homologation du vaccin et celles diffusées par les CDC à l’occasion d’une réunion de l’Advisory Committee on Immunization Practices (ACIP) le 23 avril 2021(1,2).
Caractéristiques du vaccin
Caractéristiques générales
Le vaccin à vecteur viral de Johnson & Johnson utilise un adénovirus humain de type 26 (Ad26) non réplicatif encodant la protéine de spicule (S) du SRAS-CoV-2 (lignée Wuhan) dans sa configuration préfusion. Il est produit sur la lignée cellulaire PER.C6® TetR (cellules rétiniennes humaines) et par la technologie de l’ADN recombinant. Le vaccin peut être conservé ou transporté à une température réfrigérée comprise entre 2 et 8 °C jusqu’à la date de péremption. Il doit être administré par voie intramusculaire en une seule dose de 0,5 mL (5 x 1010 particules virales). Ces deux éléments constituent des avantages par rapport aux autres vaccins disponibles qui sont autorisés pour un calendrier comportant 2 doses et qui doivent être conservés au congélateur pour les vaccins à ARNm de Pfizer et Moderna.
Immunogénicité
Les résultats d’une étude de Phases 1 et 2 chez l’humain ont montré une réponse en anticorps neutralisants et non neutralisants chez 100 % des participants avec une seule dose, ainsi qu’une réponse cellulaire des lymphocytes CD4+ et CD8+ chez une grande majorité des participants(3). Les niveaux d’anticorps ont tendance à augmenter jusqu’au 71e jour après la vaccination.
Efficacité
Le vaccin de Johnson & Johnson a été testé dans le cadre d’un essai randomisé contrôlé de Phase 3 incluant 21 895 sujets dans le groupe expérimental et 21 888 sujets dans le groupe témoin(4). La proportion de participants âgés de 65 ans et plus était de 19,6 %. Près de 41 % des participants présentaient une comorbidité bien contrôlée incluant l'obésité, l’hypertension et le diabète de type 2. L’étude s’est déroulée dans 3 régions : aux États-Unis où circulait majoritairement une souche proche de la lignée originale Wuhan qui incluait la mutation D614G, en Afrique du Sud où circulaient des souches de la lignée B.1.351 et en Amérique du Sud où circulaient des souches de la lignée P.2. L’analyse des courbes d’incidence cumulée des cas de COVID-19 entre les deux groupes montre une dissociation à partir du 14e jour suivant l’administration du vaccin. Les estimés d’efficacité sont présentés dans le tableau 1.
Il est à noter que chez les vaccinés, l’intensité des symptômes de maladie avait tendance à être moindre que chez les non-vaccinés. L’efficacité vaccinale contre les formes graves était proche de 80 %. Aucun décès n’a été constaté dans le groupe des vaccinés contre six dans le groupe témoin. L’analyse des données sérologiques a aussi montré une réduction de 74,2 % (IC 95 % : 47,1 à 88,6) des infections asymptomatiques dans le groupe expérimental (10 cas) par rapport au groupe témoin (37 cas).
Tableau 1 - Tableau 1Résultats de l’étude de Phase 3 portant sur l’efficacité clinique du vaccin de Johnson & Johnson (cas de COVID-19 confirmés par un TAAN et survenant 14 jours ou plus après l’administration du vaccin ou du placebo)
Issue | Cas groupe expérimental vs témoin | Efficacité % | IC95 % |
|---|---|---|---|
| COVID-19 modérée à grave | 116/328 | 66,9 | 59,0 à 73,4 |
| COVID-19 grave | 14/60 | 76,7 | 54,6 à 89,1 |
| COVID-19 modérée à grave, 19-59 ans sans comorbidité | 89/258 | 65,6 | 56,1 à 73,3 |
| COVID-19 modérée à grave, 18-59 ans avec comorbidité | 48/131 | 63,9 | 49,4 à 74,7 |
| COVID-19 modérée à grave, 60 ans et plus sans comorbidité | 14/57 | 76,0 | 56,3 à 87,6 |
| COVID-19 modérée à grave, 60 ans et plus avec comorbidité | 22/63 | 64,9 | 42,2 à 79,4 |
| COVID-19 modérée à grave aux États-Unis | 51/196 | 74,4 | 65,0 à 81.6 |
| COVID-19 modérée à grave en Amérique Latine | 79/223 | 64,7 | 54,1 à 73,0 |
| COVID-19 modérée à grave en Afrique du Sud | 43/90 | 52,0 | 30,3 à 67,4 |
| COVID-19 ayant entraîné le décès | 0/6 | 100,0 | - |
Globalement, la performance de ce vaccin en termes d’efficacité semble assez similaire à ce qui a été constaté dans les essais de Phase 3 pour le vaccin d’AstraZeneca avec 1 ou 2 doses(5,6), mais sensiblement moindre que les efficacités observées avec deux doses des vaccins à ARNm de Pfizer et de Moderna(7,8). Il est à noter que les estimés observés dans des essais réalisés dans des contextes épidémiologiques différents et en utilisant des définitions et des méthodes de suivi différentes doivent être interprétés avec prudence. Par ailleurs, nous ne disposons pas encore de données d’efficacité terrain pour le vaccin de Johnson & Johnson.
Sécurité
Les données sur l’innocuité du vaccin de Johnson & Johnson proviennent de l’étude de Phase 3 menée aux États-Unis, en Amérique du Sud et en Afrique du Sud(1). Un total de près de 44 000 sujets âgés de 18 ans et plus ont été randomisés pour recevoir soit le vaccin de Johnson & Johnson ou un placebo. Dans le groupe des vaccinés, 34,6 % étaient âgés de 60 ans et plus. Au moment de l’analyse, le suivi médian était de 58 jours et 56,4 % des sujets avaient été suivis pendant au moins 8 semaines. En excluant les symptômes attribuables à une infection par la COVID-19, la proportion des réactions indésirables graves rapportée était similaire dans les 2 groupes (0,4 %).
Par ailleurs, une surveillance active a été effectuée chez un sous-groupe de 6 736 participants pendant 7 jours suivant la vaccination pour des effets indésirables sollicités et pendant 28 jours suivant la vaccination pour des effets indésirables non sollicités. Parmi ce sous-groupe, une douleur au site de l’injection était la réaction locale la plus fréquemment rapportée (48,7 %). Les réactions systémiques les plus fréquentes étaient des céphalées (39,0 %), de la fatigue (38,3 %), des myalgies (33,2 %) et des nausées (14,2 %). Les réactions indésirables étaient généralement plus fréquentes chez les participants plus jeunes. La plupart des réactions sont survenues dans les 2 jours après la vaccination, étaient d’intensité légère à modérée, et duraient de 2 à 3 jours. De la fièvre (supérieure à 38 °C) a été rapportée chez 12,8 % des vaccinés âgés de 18 à 59 ans, et chez 3,1 % de ceux âgés de 60 ans et plus.
Des réactions d’hypersensibilité ont été signalées chez 0,4 % des participants ayant reçu le vaccin et chez 0,3 % des participants ayant reçu le placebo. Notons aussi dans le groupe des vaccinés, 2 cas d’œdème facial ainsi que des réactions allergiques sévères dont 1 cas d’anaphylaxie et 1 cas d’hypersensibilité de type IV (rash érythémateux) ayant débuté 2 jours après la vaccination, suivi d’urticaire généralisée et d’angio-oedème de la lèvre 4 jours après la vaccination, les symptômes étant résorbés dans les 5 semaines pour ce dernier cas.
Des événements thromboemboliques sont survenus chez 15 participants ayant reçu le vaccin et chez 10 participants ayant reçu le placebo. Chez les vaccinés, les cas où on n’a pu exclure le vaccin comme facteur contributoire incluaient : 1 cas de thrombose veineuse cérébrale (sinus transverse), 2 cas de thrombophlébite profonde, 1 cas d’embolie pulmonaire et 1 cas d’hémiparésie. Le cas de thrombose veineuse cérébrale avec thrombocytopénie confirmé par la suite comme appartenant au syndrome TTIV ou VITT (Vaccine-Induced Thrombotic Thrombocytopenia) est survenu chez un sujet masculin âgé de 26 ans. Aucune différence n’a été observée entre le groupe vacciné et le groupe témoin pour le syndrome de Guillain-Barré ou la paralysie faciale (paralysie de Bell). Aucun décès lié au vaccin n’a été signalé durant l’étude de Phase 3.
Lors de la surveillance post-commercialisation du vaccin Ad26.COV2.S aux États-Unis, des cas de thrombose avec thrombocytopénie ont été signalés, ce qui a entraîné une suspension temporaire dans l’utilisation du vaccin par la FDA et les CDC le 13 avril 2021, afin que puisse être menée une investigation approfondie sur la sécurité du vaccin.
En date du 21 avril 2021, 15 cas de thrombose avec thrombocytopénie ont été confirmés sur près de 8 millions de doses administrées, pour un taux global de 1,9 cas/million de doses(9). La majorité des cas (12/15) présentait des thromboses au niveau des sinus veineux cérébraux. Tous les cas confirmés à ce jour en dehors de celui identifié dans l’étude clinique de Phase 3 sont survenus chez des femmes âgées entre 18 et 59 ans, dont 13 chez celles âgées de 18 à 49 ans (taux de 7 cas/million de doses), et 2 chez celles âgées de 50 ans et plus (taux de 0,9 cas/million de doses). Le taux le plus élevé semble être dans le groupe d’âge de 30 à 39 ans, avec 11,8 cas/million de doses. Le délai médian entre la vaccination et le début des symptômes était de 8 jours (de 6 à 15 jours). Tous les cas présentaient une thrombocytopénie, et les 11 cas testés pour des anticorps anti-plaquettes (anti-PF4) se sont avérés positifs. En date du 21 avril 2021, 3 personnes sont décédées, 7 sont encore hospitalisées (4 aux soins intensifs) et 5 ont reçu leur congé. La surveillance et les investigations se poursuivent.
Risques et bénéfices
Afin de comparer les risques de TTIV avec les bénéfices de l’administration du vaccin de Johnson & Johnson au Québec, une analyse a été faite avec comme objectif principal de mettre en parallèle le nombre d’admissions aux soins intensifs qui pourraient être prévenues par la vaccination et le nombre de cas de TTIV pouvant survenir à la suite de la vaccination. Un horizon de 4 semaines pour estimer les bénéfices de la vaccination a été retenu.
Pour calculer les admissions aux soins intensifs prévenues par la vaccination, une extraction des transmissions préliminaires du fichier MED-ÉCHO a été faite le 26 avril pour les patients de plus de 20 ans admis entre le 28 mars et le 24 avril 2021 (semaines CDC 13 à 16), en excluant les résidents des CHSLD. Des données sur la présence d’au moins une maladie chronique (MC) associée au risque de COVID-19 sévère parmi les patients admis aux soins intensifs à partir du début de la 2e vague jusqu’au 24 avril 2021 ont aussi été extraites du Système intégré de surveillance des maladies chroniques (MC) du Québec (SISMACQ). Les rapports de risque ont été calculés sur la période du début de la 2e vague jusqu’au 24 avril 2021 pour les personnes vivant avec au moins une MC et celles en bonne santé à l’intérieur de chaque tranche d’âge examinée, et ce, pour les hommes et pour les femmes séparément. Par la suite, ces rapports ont été appliqués aux admissions aux soins intensifs observées les 4 dernières semaines, afin d’estimer les taux par sexe et selon la présence de MC. Les données ont été stratifiées par sexe et par tranches de cinq ou dix années d’âge. Une mise à jour a été faite le 29 avril 2021. Cette analyse est basée sur l’hypothèse que l’utilisation du vaccin Johnson & Johnson permettrait à une personne en bonne santé de devancer de quatre semaines le moment de sa vaccination avec un vaccin à ARN messager (d’où l’utilisation d’une période de 4 semaines), avec une efficacité de 80 % pour prévenir les admissions aux soins intensifs. Il a aussi été considéré que l’incidence de la COVID-19 au cours des prochaines semaines allait être identique à celle des quatre dernières semaines. En ce qui concerne le risque de TTIV exprimé en nombre de cas par 100 000 doses du vaccin Johnson & Johnson administrées, les données rendues disponibles aux États-Unis(2) ont été utilisées. Les tranches d’âge ont été regroupées, afin de refléter les risques rapportés. La tranche de 40 à 49 ans est toutefois présentée séparément pour les 40-44 ans et les 45-49 ans étant donné les différences importantes dans les risques observés récemment dans ces groupes au Québec. Le même risque de TTIV que celui rapporté chez les 40-49 ans a été appliqué à ces deux tranches d’âge. Une multiplication du risque de TTIV par deux pour les femmes et par 4 pour les hommes a été faite, afin de tenir compte d’une possible sous-déclaration des cas, possiblement plus importante chez les hommes.
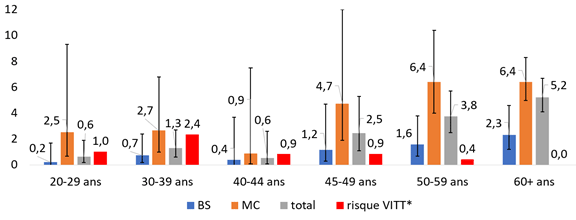
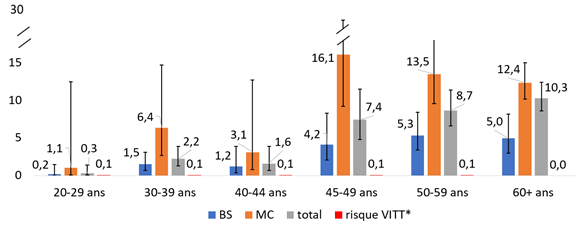
Les figures 1A et 1B mettent en parallèle les estimations du nombre d’admissions aux soins intensifs prévenues par 100 000 personnes vaccinées (taux/100 000) avec le nombre de cas de TTIV par 100 000 personnes vaccinées avec le vaccin de Johnson & Johnson, selon le sexe et la présence d’au moins une MC. Sur une période de 4 semaines, la vaccination permettrait aux femmes de 45 ans et plus de prévenir un nombre d’admissions aux soins intensifs plus élevé par rapport au risque de TTIV (figure 1A). L’écart est moins important chez les femmes de 45-59 ans en bonne santé; le nombre d’admissions aux soins intensifs par 100 000 n’est pas significativement différent du risque de TTIV par 100 000 chez les femmes de 45‑49 ans. Il est à noter que le niveau d’incertitude (les intervalles de confiance) pour le risque du TTIV n’est pas disponible à ce moment. Chez les hommes (figure 1B), la vaccination permettrait de prévenir un nombre d’admissions aux soins intensifs beaucoup plus élevé par rapport au risque de TTIV à partir de 30 ans, peu importe la présence ou non de MC. Chez les hommes de moins de 30 ans, le nombre d’admissions aux soins intensifs prévenues par la vaccination est comparable au risque de TTIV.
Figure 1A - Nombre d’admissions aux soins intensifs pour COVID-19 prévenues et nombre de cas de TTIV (ou VITT) par 100 000 femmes vaccinées avec le vaccin de Johnson & Johnson
BS : en bonne santé; MC : malades chroniques.
Notes : L’efficacité vaccinale est estimée à 80 %. *La multiplication par 2 du risque de TTIV vise à tenir compte d’une possible sous-déclaration des cas. L’intervalle de confiance a été calculé en utilisant une approximation normale des taux.
Figure1B - Nombre d’admissions aux soins intensifs pour COVID-19 prévenues et nombre de cas de TTIV ou VITT par 100 000 hommes vaccinés avec le vaccin de Johnson & Johnson
BS : en bonne santé; MC : malades chroniques.
Notes : L’efficacité vaccinale est estimée à 80 %. *La multiplication par 4 du risque de TTIV vise à tenir compte d’une possible sous-déclaration des cas. L’intervalle de confiance a été calculé en utilisant une approximation normale des taux.
Acceptabilité
Il est difficile de prédire comment sera accepté le vaccin de Johnson & Johnson dans le contexte actuel au Québec. De manière générale, un vaccin sécuritaire et/ou plus efficace est mieux perçu qu’un vaccin moins sécuritaire et/ou moins efficace(10).
Les sondages hebdomadaires réalisés par l’INSPQ indiquent une acceptabilité élevée pour la vaccination contre la COVID-19. Par exemple, pour la semaine du 16 au 22 avril, 38 % des participants rapportaient avoir reçu une dose de vaccin et, parmi les répondants non vaccinés, 78 % avaient l’intention de recevoir le vaccin lorsqu’ils le pourront(11). Une intention de vaccination plus faible est observée parmi les répondants âgés entre 25 et 34 ans (71 %), chez ceux ayant un niveau d’éducation secondaire ou moins (69 %), chez ceux qui ne sont pas nés au Canada (74 %) et chez les répondants qui vivent dans de petites villes ou dans un milieu rural. Une perception de faible risque lié à la COVID-19, le fait d’adhérer à des théories du complot et le fait de ne pas suivre d’autres mesures de prévention de la COVID-19 (par exemple : lavages des mains, distanciation physique) sont aussi associés à une intention plus faible de recevoir le vaccin. Enfin, dans les sondages, le manque de confiance en la vaccination en général et les craintes liées aux effets secondaires possibles demeurent les principales raisons évoquées par les répondants qui ne souhaitent pas se faire vacciner contre la COVID-19.
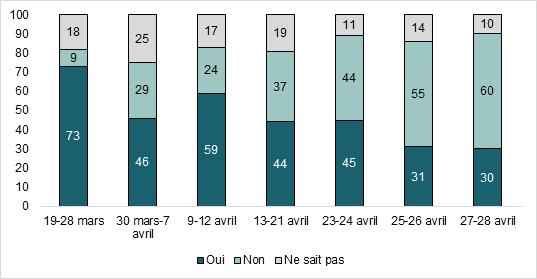
Dans les sondages de l’INSPQ, une question vise à connaître l’intention des répondants d’accepter le vaccin d’AstraZeneca s’il leur est offert (figure 2). Une diminution importante a été observée suite à l’annonce de la suspension du vaccin chez les personnes de 55 ans et moins le 29 mars. Une augmentation de l’intention a été observée suite à l’offre du vaccin sans rendez-vous chez les personnes de 55 ans et plus le 9 avril. Cette augmentation de l’intention ne s’est toutefois pas maintenue dans le temps. Chez les répondants de 45 à 54 ans, pour qui le vaccin AstraZeneca est offert depuis le 21 avril, l’intention d’accepter ce vaccin était de 54 % pour les sondages du 23 et 24 avril, de 46 % pour les sondages du 25 et 26 avril et de 35 % pour les sondages du 27 et 28 avril (données non présentées dans la figure).
Figure 2 - Évolution de l’intention d’accepter le vaccin AstraZeneca parmi les répondants âgés de 55 ans et plus, sondages du 19 mars au 28 avril 2021
Un sondage réalisé auprès de 1 018 Canadiens durant la semaine du 8 avril révélait que tous les vaccins n’étaient pas perçus de manière similaire. En effet, parmi ceux ayant l’intention de se faire vacciner, 90-92 % se sentaient à l’aise avec un vaccin à ARNm (Pfizer-BioNTech ou Moderna), 70 % avec le vaccin de Johnson & Johnson et seulement 41 % avec celui d’AstraZeneca(12). Il est à noter que ce sondage a été réalisé après la médiatisation des effets secondaires rares avec le vaccin d’AstraZeneca, mais avant la médiatisation de ceux rapportés aux États-Unis avec le vaccin de Johnson & Johnson.
En termes de communication, un des enjeux sera de positionner le vaccin de Johnson & Johnson par rapport aux trois autres au vu des avantages qu’il présente pour ses conditions de stockage et transport par rapport aux vaccins à ARNm, de son autorisation pour un calendrier à une dose par rapport aux vaccins actuellement utilisés et de son efficacité contre certains variants par rapport au vaccin d’AstraZeneca, tout en reconnaissant les risques qu’il présente.
Conformité
Santé Canada a examiné les données disponibles concernant les événements de thrombose et de thrombocytopénie associés au vaccin de Johnson & Johnson contre la COVID-19 rapportés aux États-Unis et a conclu qu'il existe un lien possible avec l'utilisation de ce vaccin(13). La monographie du produit et les étiquettes ont été mises à jour pour refléter les données disponibles, mais comme aucun facteur de risque spécifique pour ces événements n'a été identifié, Santé Canada n'a pas mis en place de restrictions spécifiques sur l'utilisation du produit et continue de conclure que les avantages de la vaccination contre la COVID-19 l'emportent sur les risques de cet événement très rare.
De son côté, le Comité consultatif national sur l’immunisation recommande l’utilisation du vaccin contre la COVID-19 de Johnson & Johnson avec les mêmes restrictions que celles énoncées pour le vaccin d’AstraZeneca(14). La recommandation générale concernant les vaccins contre la COVID-19 est d’offrir de manière préférentielle un des vaccins à ARNm pour tous les groupes d’âge pour lesquels ils sont autorisés et en absence d’une contre-indication à l’utilisation de ces vaccins. Les vaccins à vecteur viral peuvent être offerts aux personnes âgées de 30 ans et plus lorsque certaines conditions sont remplies, incluant une évaluation des risques et avantages tenant compte du délai prévu pour recevoir un vaccin à ARNm et d’autres mesures de santé publique efficaces, afin de réduire le risque de contracter la COVID-19, ainsi qu’une information complète aux personnes sur ces sujets.
En date du 23 avril 2021, à la suite d’une analyse soigneuse des risques-bénéfices, la FDA et les CDC ont recommandé la reprise de l’utilisation du vaccin de Johnson & Johnson chez les personnes de 18 ans et plus, avec l’ajout des informations dans la monographie sur le risque de thrombose avec thrombocytopénie pouvant survenir à la suite du vaccin(9).
Recommandations
Le vaccin Ad26.COV2.S de Johnson & Johnson appartient à la catégorie des vaccins à vecteur viral dont le profil d’innocuité et d’efficacité est différent de celui des vaccins à ARNm contre la COVID-19. La haute sécurité et efficacité des vaccins à ARNm font que ce type de produit devrait être offert de manière préférentielle à tous les individus qui appartiennent aux groupes pour lesquels ils sont autorisés et qui ne présentent pas de contre-indication. Cette recommandation générale est conforme à celle émise par le Comité consultatif national sur l’immunisation(14).
Par rapport aux vaccins à ARNm, le vaccin de Johnson & Johnson est plus facile à entreposer et à transporter, car il peut être conservé à une température réfrigérée comprise entre 2 et 8 °C jusqu’à la date de péremption. Le fait qu’il soit autorisé pour une utilisation avec une seule dose peut faciliter son acceptabilité et constitue un avantage majeur dans certaines situations. Finalement, le fait qu’il ait démontré une bonne efficacité contre les formes modérées à sévères de COVID-19 dues aux variants originaires d’Afrique du Sud ou du Brésil est un autre élément à considérer. Ce vaccin sera livré en petite quantité au Québec par rapport aux autres vaccins déjà homologués et en cours d’utilisation. Il ne contribuera donc pas de manière importante aux deux principaux objectifs du programme d’immunisation contre la COVID-19 qui sont de réduire le fardeau de la maladie dans la population et de maintenir une bonne capacité du système de santé(15).
La survenue de cas de thrombose avec thrombocytopénie (VITT) suite à son administration témoigne d’un possible effet de classe retrouvé avec le vaccin d’Astrazeneca(16). L’hypothèse suivant laquelle les effets secondaires constatés avec le vaccin de Johnson & Johnson (environ 2 cas par million de doses tous sexes confondus, 4 cas par million chez les femmes et 0,25 par million chez les hommes suivant les données disponibles à ce jour) seraient en réalité aussi fréquents qu’avec le vaccin d’AstraZeneca (environ 10 cas par million de doses) et distribués uniformément en fonction de l’âge et du sexe apparaît peu plausible dans l’état actuel des connaissances.
Des recommandations spécifiques en fonction du risque d’exposition au SRAS-CoV-2, de maladie et de complication ainsi qu’en fonction de l’âge et du sexe apparaissent donc pertinentes. Il faut aussi mentionner que c’est surtout pour les personnes plus jeunes et en bonne santé que l’utilisation du produit de Johnson & Johnson pourrait amener un devancement de la vaccination. Toutefois, la disponibilité des vaccins à ARNm s’accélère au Québec et le temps d’attente pour ce type de vaccin se réduit pour tous les groupes. Ce facteur est très important et doit être pris en compte pour évaluer le ratio risque-bénéfice de la vaccination d’un individu avec le vaccin de Johnson & Johnson.
Indications
Le CIQ recommande l’utilisation du vaccin de Johnson & Johnson chez les personnes de 18 ans et plus (âge de l’homologation) qui présentent une contre-indication à l’utilisation d’un vaccin à ARNm.
Le vaccin de Johnson & Johnson pourrait être offert aux femmes âgées de 60 ans ou plus ou aux hommes âgés de 30 ans et plus qui veulent se prévaloir d’un calendrier vaccinal ne comportant qu’une seule dose ou qui ne veulent pas attendre pour recevoir un vaccin à ARNm.
L’utilisation du vaccin de Johnson & Johnson pourrait être envisagée pour des personnes âgées de 18 ans et plus dans des circonstances exceptionnelles, lorsque les conditions de stockage et de transport rendraient quasiment impossible l’utilisation d’un vaccin à ARNm ou lorsqu’il serait hautement probable que l’individu ne se représente pas pour recevoir une deuxième dose de vaccin, afin de compléter son calendrier. Dans de telles circonstances, l’analyse du ratio risque-bénéfice de la vaccination ne doit pas se faire sur une période courte de quelques semaines, tel que présenté à la section « risques et bénéfices », mais bien dans une perspective à plus long terme.
Dans tous les cas, l’offre du vaccin de Johnson & Johnson devrait s’accompagner d’une information complète sur les avantages, les risques et les inconvénients de ce vaccin et des autres. Plus spécifiquement, les personnes vaccinées devraient être informées du très faible risque de thrombose avec thrombocytopénie qui peut avoir des conséquences graves, incluant le décès. Les personnes vaccinées devraient être avisées d’obtenir rapidement des soins médicaux si elles présentent certains symptômes (essoufflement, douleur à la poitrine, enflure des jambes, douleur abdominale, maux de tête graves ou persistants, vision brouillée, ecchymoses ou petites taches sanguines à un autre endroit que celui du point d’injection) apparaissant 4 à 20 jours après la vaccination. Les professionnels de la santé devraient être à l’affût de symptômes qui pourraient indiquer une thrombose avec thrombocytopénie (TTIV) chez les personnes vaccinées récemment avec ce produit, et suivre les lignes directrices applicables, le cas échéant.
Contre-indications
Une histoire de réaction allergique grave antérieure (exemple : anaphylaxie) à tout composant ou à une dose du vaccin de Johnson & Johnson représente une contre-indication à la vaccination avec ce produit.
Par précaution malgré l’absence de données, les personnes avec un antécédent de thrombocytopénie induite par l’héparine (HIT-Heparin Induced Thrombocytopenia) ne devraient pas recevoir le vaccin de Johnson & Johnson.
Précautions, interchangeabilité et interactions
Les précautions pourraient être les mêmes que celles des autres vaccins à vecteur viral (vaccin d’AstraZeneca). Il pourrait en être de même pour les questions d’interchangeabilité et d’interaction. Les avis du CIQ et du CCNI concernant l’utilisation des vaccins contre la COVID-19 peuvent être consultés à cet effet.
Conclusions
Les recommandations concernant l’utilisation du vaccin Ad26.COV2.S de Johnson & Johnson au Québec ont été établies en fonction des informations disponibles à la date du 30 avril 2021 et doivent donc être considérées comme provisoires. La situation épidémiologique peut changer brusquement, comme cela a été constaté à maintes reprises. Par ailleurs, plusieurs essais cliniques sont en cours avec le vaccin de Johnson & Johnson pour tester l’innocuité, l’immunogénicité et l’efficacité clinique de calendriers comportant 2 doses avec différents intervalles (NCT04614948; NCT04436276) et d’autres études sont déjà entreprises sur des calendriers mixtes comportant des vaccins à vecteur viral et à ARNm. Les recommandations présentes pourraient donc être modifiées en fonction de l’avancement des connaissances sur les vaccins, de l’évolution de la situation épidémiologique et de la disponibilité des vaccins contre la COVID-19.
Références
- Janssen Inc. Janssen COVID vaccine. Monographie du produit [Internet]. 2021. Disponible sur : https://covid-vaccine.canada.ca/info/pdf/janssen-covid-19-vaccine-pm-fr.pdf
- Shimabukuro T. Thrombosis with thrombocytopenia syndrome (TTS) following Janssen COVID-19 vaccine. Advisory Committee on Immunization Practices (ACIP) April 23, 2021 [Internet]. Disponible sur : https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-04-23/03-COVID-Shimabukuro-508.pdf
- Sadoff J, Le Gars M, Shukarev G, Heerwegh D, Truyers C, de Groot AM, et al. Interim Results of a Phase 1-2a Trial of Ad26.COV2.S Covid-19 Vaccine. N Engl J Med [Internet]. 2021; Disponible sur : https://pubmed.ncbi.nlm.nih.gov/33440088/
- Janssen Biotech Inc. COVID-19 Vaccine Ad26.COV2.S. VAC31518 (JNJ-78436735). Sponsor briefing document [Internet]. 2021. Disponible sur : https://www.fda.gov/media/146219/download
- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397(10269):99‑111.
- Voysey M, Costa Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. Lancet. 2021;397(10277):881‑91.
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;384(5):403‑16.
- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383(27):2603‑15.
- Centers for Disease Control and Prevention. CDC Recommends Use of Johnson & Johnson’s Janssen COVID-19 Vaccine Resume [Internet]. 2021. Disponible sur : https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/JJUpdate.html
- Verelst F, Kessels R, Willem L, Beutels P. No Such Thing as a Free-Rider? Understanding Drivers of Childhood and Adult Vaccination through a Multicountry Discrete Choice Experiment. Vaccines. 16 mars 2021;9(3):264.
- Institut national de santé publique du Québec. COVID-19 – Sondages sur les attitudes et comportements des adultes québécois - Données du 16 au 22 avril [Internet]. 2021. Disponible sur : https://www.inspq.qc.ca/covid-19/sondages-attitudes-comportements-quebecois
- Angus Reid Institute. All but AstraZeneca? Most unvaccinated Canadians uncomfortable with brand; fewer would take the jab if offered [Internet]. 2021. Disponible sur : https://angusreid.org/astrazeneca-confidence/
- Santé Canada. Portail des vaccins et traitements pour la COVID-19 [Internet]. 2021. Disponible sur : https://vaccin-covid.canada.ca/
- Comité consultatif national de l’immunisation. Recommandations sur l’utilisation des vaccins contre la COVID-19 [Internet]. 2021. Disponible sur : https://www.canada.ca/fr/sante-publique/services/immunisation/comite-consultatif-national-immunisation-ccni/recommandations-utilisation-vaccins-covid-19.html
- Comité sur l’immunisation du Québec. Avis préliminaire sur les groupes prioritaires pour la vaccination contre la COVID-19 au Québec [Internet]. 2021. Disponible sur : /sites/default/files/publications/3085-groupes-prioritaires-vaccination-covid19.pdf
- Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med. 2021;NEJMoa2104840.