Réponse à la demande d’évaluation de la pertinence d’une vaccination contre les infections pneumococciques des travailleurs exposés à des poussières et fumées au Québec
Avis court du Comité sur l'immunisation du Québec
Mise en contexte
En mai 2019, la Communauté médicale de pratique en santé au travail du Québec (CMPSATQ) a fait une demande au Comité sur l’immunisation du Québec (CIQ) pour évaluer la pertinence d’un ajout des indications de vaccination préventive contre le pneumocoque (Indication : R) pour les travailleurs exposés « souvent ou tout le temps » aux fumées de soudage. Advenant une telle recommandation, les questions posées concernent le ou les vaccins à utiliser, le moment de la vaccination dans la carrière d’un travailleur et la pertinence d’une revaccination. La CMPSATQ rapporte qu’environ 94 000 personnes au Québec sont exposées « souvent » ou « tout le temps » aux fumées de soudage dans le cadre de leur travail. Toujours selon la CMPSATQ, cette demande est justifiée, entre autres, par le fait que le ‘Joint Committee on Vaccination at the English Department of Health’ a recommandé en 2011 que les employeurs offrent aux soudeurs le vaccin pneumococcique polysaccharidique 23-valent (VPP-23).
Pour soutenir cette demande, la CMPSATQ apporte deux documents, le premier étant une revue des écrits réalisée en 2013 et le second, une première évaluation de la pertinence d’une vaccination de certaines catégories de travailleurs en faisant référence aux critères décisionnels proposés par Erickson et collaborateurs (2005)1. En septembre 2019, un autre document consistant en une mise à jour de la recension des écrits est transmis au CIQ.
Lors de la réunion plénière du CIQ de juin 2019, deux membres du CMPSATQ font une présentation des principaux éléments qui justifient leur demande et cela est suivi d’une discussion. Lors de la réunion plénière du CIQ de septembre 2019, les principaux enjeux associés à la demande sont discutés et il est convenu de préparer une réponse écrite destinée à définir la démarche à suivre dans ce dossier complexe. La recommandation du CIQ est d’abord présentée suivie des enjeux concernant le fardeau de la maladie et la stratégie vaccinale.
Recommandation du CIQ
Il apparaît qu’il existe un grand nombre d’incertitudes sur le fardeau des infections respiratoires et pneumococciques qui pourraient être associées à l’exposition chronique de certains travailleurs aux fumées et poussières, ainsi que sur la stratégie vaccinale optimale pour réduire ce fardeau. Dans l’état actuel des connaissances, le CIQ n’est pas en mesure de recommander l’ajout d’une indication de vaccination contre le pneumocoque chez les travailleurs exposés aux fumées et poussières.
Pour avancer dans ce dossier, il serait nécessaire de procéder à une évaluation systématique des études disponibles concernant le risque de maladie incluant leur qualité et produire, si possible, des estimés robustes de risque puis procéder à une modélisation de l’impact probable de différentes stratégies vaccinales. De tels travaux nécessiteraient des ressources dédiées et une priorisation devrait être discutée avec les différentes organisations impliquées dans ce dossier.
Vu la durée des expositions professionnelles qui peut s’étendre sur plusieurs dizaines d’années, un autre élément incontournable est de procéder à une revue systématique des écrits portant sur la durée de la protection conférée par le VPP-23, la sécurité, l’immunogénicité et l’efficacité d’une revaccination. Une étude a été publiée à ce sujet2, mais la revue systématique devrait être actualisée et inclure des informations sur la durée de la protection clinique.
Une autre piste qui pourrait être proposée serait de planifier une étude prospective portant sur un échantillon de travailleurs exposés aux fumées et poussières en vue de déterminer le risque de pneumonie et leur étiologie en utilisant des tests urinaires permettant d’identifier le Sp et les sérotypes incriminés3.
En lien avec les incertitudes soulevées, la question des nombreuses conditions à risque qui pourraient justifier une vaccination, voire une revaccination contre le pneumocoque avec le VPP-23 reste d’actualité. Dans un souci d’équité, toutes les personnes qui présentent un risque considéré comme inacceptable d’infection pneumococcique invasive et non invasive devraient faire l’objet d’une recommandation pour autant que des critères de coût-efficacité soient atteints. Il faut à ce propos souligner que le coût du VPP-23 est en augmentation au Canada, ce qui rend caduques les évaluations économiques réalisées à ce jour. Des vaccins conjugués 15-valent et 20-valent sont en cours de développement et cela pourrait également modifier les recommandations.
Complément d’information
Incertitudes concernant le risque de maladie
Les résultats des études reprises dans les deux revues des écrits réalisées par le CMPSATQ suggèrent fortement l’existence d’un risque accru de pneumonie infectieuse et d’infection invasive à pneumocoque (IIP) chez les travailleurs exposés de manière chronique à des fumées métalliques associées à la soudure, ainsi qu’aux poussières inorganiques incluant l’amiante, le ciment, le granite, la chaux et le plâtre. Les études sont très hétérogènes au niveau des devis, de la taille des effectifs qui déterminent la précision statistique des estimés, des indicateurs d’expositions et des issues, de même que du contrôle des facteurs de confusion potentiels, le plus important étant le tabagisme. En conséquence, il serait impossible de réaliser une méta-analyse quantitative destinée à produire un estimé robuste des risques relatifs et absolus de pneumonie infectieuse ou d’IPP chez ces travailleurs.
Les estimés de risques relatifs cités dans les différentes études se situent généralement dans une fourchette comprise entre 2 et 6. Pour mémoire, une étude cas-témoins de très bonne qualité réalisée aux États-Unis a mis en évidence un risque relatif d’IIP de 4,1 pour le tabagisme actif (IC95 % : 2,4 à 7,3) et de 2,5 pour le tabagisme passif (IC95 % : 1,2 à 5,1)4.
La plausibilité biologique d’un risque associé aux fumées et poussières est évidente, bien que les mécanismes pathogènes ne soient pas encore bien établis. Par ailleurs, les données disponibles ne permettent pas de déterminer s’il existe ou non un seuil d’exposition en dessous duquel n’existe aucun risque accru, une relation dose-effet, un effet cumulatif à la suite des expositions répétées et un passage à des lésions tissulaires irréversibles qui entraînent, elles-mêmes, un risque accru indépendamment de toute nouvelle exposition.
Un autre problème est l’étiologie des infections qui pourraient être associées au risque lié à l’exposition aux fumées et poussières. L’existence d’un risque accru pour les IIP suggère fortement que le pneumocoque pourrait être en cause dans les pneumonies non bactériémiques chez les travailleurs exposés, mais la fraction des pneumonies de toutes causes qui pourrait être attribuable à ce pathogène chez les travailleurs exposés est inconnue. Il existe également une incertitude sur la distribution des sérotypes pneumococciques qui pourraient être impliqués dans les infections invasives et les pneumonies pneumococciques non bactériémiques chez les travailleurs exposés. Il est possible que la distribution des sérotypes qui se retrouvent dans des pneumonies associées à une exposition aux poussières et fumées soit différente de celle que l’on retrouve dans la population générale et cela a des implications pour le choix d’un vaccin, celui offrant la plus large couverture apportant plus de sécurité.
Incertitudes quant à la capacité de prévenir les infections à pneumocoque chez les travailleurs exposés
Tout d’abord, la réduction des émanations à la source et les moyens de protection individuelle ou collective des travailleurs devraient être priorisés avant de songer à une vaccination qui ne peut corriger qu’une partie du problème.
Une première question concerne le vaccin à utiliser. La distribution des sérotypes de Streptococcus pneumoniae qui causent les infections invasives chez les adultes de 20 à 64 ans au Québec figure dans le Tableau 1. Le vaccin pneumococcique conjugué 13- valent (VPC-13) couvre les sérotypes d’entre 31 % et 36 % des cas, alors que le VPP-23 couvre de 69 % à 77 % des sérotypes de souches invasives. Il est probable que les proportions soient relativement similaires pour les pneumonies non invasives. A priori, le VPP-23 serait donc à privilégier dans l’hypothèse d’un recours à une vaccination.
Tableau 1 Distribution des cas d’infection invasive à pneumocoque chez les personnes âgées entre 20 et 64 ans au Québec, 2016-2018 (sources : fichiers MADO et LSPQ)
| Sérotype des cas | Nombre de cas (MADO) | % (MADO) | Taux/100 000 p.-a (MADO) | Nombre de cas (LSPQ sentinelles) | % (LSPQ sentinelles) | Taux/ 100 000 p.-a estimé** |
|---|---|---|---|---|---|---|
| 3 | 117 | 10 % | 0,77 | 41 | 11 % | 0,82 |
| Autres sérotypes figurant dans le VPC-13 | 239 | 21 % | 1,58 | 91 | 25 % | 1,83 |
| Sérotypes figurant dans le VPP-23 et non dans le VPC-13 | 423 | 38 % | 2,80 | 149 | 41 % | 2,99 |
| Sérotyoes ne figurant dans aucun vaccin | 223 | 20 % | 1,47 | 86 | 23 % | 1,72 |
| Souches non typables* | 3 | 0 % | 0,02 | 0 | 0 % | 0 |
| Inconnu | 111 | 10 % | 0,73 | 0 | 0 % | 0 |
| Total | 1116 | 7,38 | 367 | 7,38 |
* Non sérogroupable/non sérotypable, non capsulé.
** Estimé à partir des taux MADO et des proportions dans le réseau sentinelle.
Bien qu’un vaccin conjugué induise une réponse immunitaire plus intense et de meilleure qualité qu’un vaccin polysaccharidique5, une différence quant à l’efficacité à court terme pour la prévention des infections invasives chez les adultes n’est pas démontrée comme l’attestent les données figurant dans le Tableau 2. Le VPC-13 a démontré une efficacité de l’ordre de 40 % pour la prévention des pneumonies non bactériémiques causées par les sérotypes vaccinaux dans un essai randomisé, alors que l’efficacité du VPP-23 pour cette issue fait l’objet d’une controverse. Toutefois, des études récentes présentées au Tableau 2 suggèrent que le VPP-23 pourrait avoir une certaine efficacité pour les pneumonies non invasives. Il est à noter que les résultats des études utilisant la méthode de la cohorte indirecte ou ‘test-negative’ doivent être interprétés avec prudence, car il n’est pas exclu que les estimés d’efficacité contre les infections pneumococciques causées par des sérotypes vaccinaux soient biaisés si le risque de colonisation précédant la maladie est lié au statut vaccinal. Par ailleurs, nous ne disposons pas de données sur l’efficacité d’un schéma de vaccination des adultes comportant une dose de VPC-13 suivie d’une dose de VPP-23 comme cela est recommandé dans certains pays.
Le talon d’Achille des vaccins pneumococciques est leur efficacité contre les infections de sérotype 3, non démontrée pour le VPP-23 et probablement modeste pour le VPC-136-8. Le sérotype 3 est en augmentation chez les adultes au Québec et cela a des conséquences sur l’efficacité de tout programme de vaccination.
Toutes ces données soutiennent le choix du VPP-23 advenant une recommandation vaccinale chez des travailleurs. C’est le choix qui a été fait au Royaume-Uni pour la vaccination des travailleurs exposés aux poussières, mais non dans d’autres pays à notre connaissance. Il est à noter que l’utilisation du VPC-13 chez les adultes au Québec est uniquement recommandée pour les personnes à risque très élevé d’infection invasive (personnes aspléniques ou immunodéprimées) en raison de la meilleure réponse immunitaire générée par ce vaccin par rapport au vaccin polysachharidique dans ces groupes.
Tableau 2 Efficacité du vaccin pneumococcique polysaccharidique 23-valent (VPP- 23) et du vaccin pneumococcique conjugué 13-valent (VPC-13) chez des adultes pour la prévention des infections invasives à pneumocoque (IIP) et des pneumonies pneumococciques non invasives (PPNI)
| Vaccin | Type d’étude | Issue | Population | Efficacité | Référence |
|---|---|---|---|---|---|
| VPP | Méta-analyse d’essais randomisés | IIP de sérotypes vaccinaux | Adultes immunocompétents | 82 % | Moberley et collab., 20139 |
| Méta-analyse d’études observationnelles | IIP de sérotypes vaccinaux | Adultes immunocompétents | 60 % | ||
| VPP-23 | Étude de cohorte indirecte | IIP de sérotypes vaccinaux | 65-74 ans immunocompétents | 63 % (< 2 ans après vaccination) 21 % (2-4 ans après vaccination) | Djennad et collab., 20196 |
| VPP-23 | Étude de cohorte prospective | IIP et PPNI de sérotypes vaccinaux | 65-74 ans | 40 % | Suzuki et collab., 2017(10) |
| VPP-23 | Étude cas-témoin | IIP de sérotypes vaccinaux | 65-74 ans | 70 % (82 % en excluant le sérotype 3) | Kim et collab., 201911 |
| PPNI de sérotypes vaccinaux | 65-74 ans | 21 % (31 % en excluant le sérotype 3) | |||
| VPC-13 | Essai randomisé | IIP de sérotypes vaccinaux | 65 ans et plus | 76 % | Bonten et collab., 201512 |
| PPNI de sérotypes vaccinaux | 65 ans et plus | 41 % | |||
| VPC-13 | Étude chez des patients hospitalisés par la méthode ‘test-negative’ | PPNI de sérotypes vaccinaux | 65 ans et plus | 73 % | McLaughlin et collab., 201813 |
Une deuxième question est la durée de protection conférée par les vaccins. Nous savons que pour tous les vaccins polysaccharidiques ou conjugués, les niveaux d’anticorps sériques et la protection diminuent avec le temps. Pour le VPC-13, nous ne disposons que de données à court terme sur l’efficacité clinique. Pour le VPP-23, les résultats d’une étude récente au Royaume-Uni décrits dans le Tableau 26 suggèrent un niveau élevé de protection contre les infections invasives durant les deux premières années après l’administration d’une première dose et un niveau faible durant les 3 années suivantes. Sachant que l’exposition des travailleurs peut perdurer durant plusieurs décennies, des scénarios de revaccination doivent être envisagés. Il existe des données qui montrent qu’une revaccination avec le VPP-23 est sécuritaire et que les niveaux d’anticorps sont similaires à ceux produits par une primovaccination2. Il n’existe toutefois pas de données concernant l’efficacité clinique d’une revaccination et les données concernant des vaccinations répétées sont très fragmentaires.
Advenant une recommandation vaccinale des travailleurs, une autre question délicate est celle du moment de la vaccination dans une carrière professionnelle qui peut débuter dès l’âge de 18 ans pour finir à 65 ans. Le risque d’IIP et d’hospitalisation pour pneumonie au Québec est illustré dans les Figures 1 et 2. Chez les adultes en âge de travailler, le taux des IIP augmente de 2,0/100 000 personnes-années (p.-a) chez les 20-29 ans à 16,7/100 000 chez les 60-64 ans, avec une moyenne de 7,5/100 000 (IC95 % : 7,2 à 7,9) chez les 20-64 ans.
Le risque d’hospitalisation pour pneumonies de toutes causes à l’âge de 20 ans est de 2,2 pour 10 000 personnes-années et augmente à 28,6/10 000 à l’âge de 64 ans, pour une moyenne de 8,3/10 000 dans le groupe des 20 à 64 ans. Il est difficile d’estimer la proportion de pneumonies de toutes causes qui sont attribuables au pneumocoque vu les problèmes de sensibilité et spécificité des tests diagnostiques incluant les tests de détection d’antigènes dans les urines. Dans une étude de modélisation au Royaume-Uni basée sur des données de surveillance des pathogènes respiratoires et des hospitalisations pour infection respiratoire aiguë en 2000-2007, l’estimation de la fraction des admissions attribuables au pneumocoque chez les personnes âgées de 15 à 64 ans était de 44 %14. Il n’est toutefois pas impossible que cette proportion soit surestimée du fait de la méthodologie utilisée pour produire cette estimation.
Pour ces deux issues, le risque supplémentaire associé à une exposition professionnelle pourrait être additif par rapport au risque de base ou multiplicatif avec un risque relatif augmenté de manière constante par rapport au risque de base. En tout état de cause, une vaccination serait plus rentable en fin de carrière professionnelle qu’en début, et cela augmente le degré d’incertitude d’une recommandation sachant que la fin de l’exposition professionnelle en cours de carrière ou la date de fin de carrière sont assez imprévisibles.
Figure 1 Taux d’incidence (par 100 000 personnes-années) des infections invasives à pneumocoque parmi les 20-64 ans par année d’âge dans la population active au Québec, 2015-2018
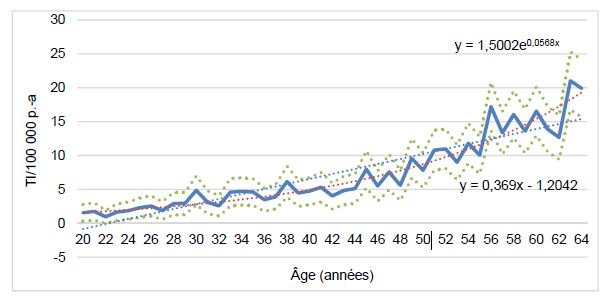
Source : Fichier MADO. Les intervalles de confiance ainsi que les courbes de régression linéaire et exponentielle des taux en fonction de l’âge sont également représentés.
Figure 2 Taux d'hospitalisation pour pneumonies de toutes causes (diagnostic principal) par année d'âge au Québec, années administratives avril-mars 1997-1998 à 2015-2016
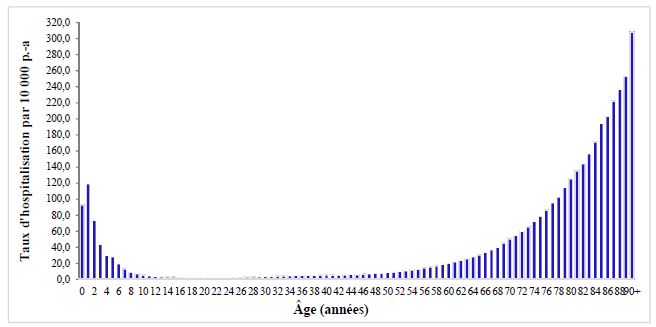
Source : fichier Med-Écho.
Synthèse
En somme, de nombreuses incertitudes demeurent concernant le fardeau de la maladie chez les travailleurs exposés aux fumées et poussières ainsi que sur la stratégie de vaccination optimale pour réduire ce fardeau. Dans l’état actuel des connaissances, le CIQ n’est pas en mesure de recommander l’ajout d’une indication de vaccination contre le pneumocoque chez les travailleurs exposés aux fumées et poussières.
Références
- Erickson LJ, De Wals P, Farand L. An analytical framework for immunization programs in Canada. Vaccine. 31 March 2005;23(19):2470‑6.
- Caya CA, Boikos C, Desai S, Quach C. Dosing regimen of the 23-valent pneumococcal vaccination: a systematic review. Vaccine. 10 March 2015;33(11):1302‑12.
- Eletu SD, Sheppard CL, Thomas E, Smith K, Daniel P, Litt DJ, et al. Development of an Extended-Specificity Multiplex Immunoassay for Detection of Streptococcus pneumoniae Serotype-Specific Antigen in Urine by Use of Human Monoclonal Antibodies. Clin Vaccine Immunol CVI. Dec 2017;24(12):00262-17.
- Nuorti JP, Butler JC, Farley MM, Harrison LH, McGeer A, Kolczak MS, et al. Cigarette smoking and invasive pneumococcal disease. Active Bacterial Core Surveillance Team. N Engl J Med. 9 March 2000;342(10):681‑9.
- de Roux A, Schmole-Thoma B, Siber GR, Hackell JG, Kuhnke A, Ahlers N, et al. Comparison of pneumococcal conjugate polysaccharide and free polysaccharide vaccines in elderly adults: conjugate vaccine elicits improved antibacterial immune responses and immunological memory. Clin Infect Dis. 1 Apr 2008;46(7):1015‑23.
- Djennad A, Ramsay ME, Pebody R, Fry NK, Sheppard C, Ladhani SN, et al. Effectiveness of 23-Valent Polysaccharide Pneumococcal Vaccine and Changes in Invasive Pneumococcal Disease Incidence from 2000 to 2017 in Those Aged 65 and Over in England and Wales. EClinicalMedicine. Dec 2018;6:42‑50.
- De Wals P. Commentary on paradoxical observations pertaining to the impact of the 13-valent pneumococcal conjugate vaccine on serotype 3 Streptococcus pneumoniae infections in children. Vaccine. 2018;36(37):5495‑6.
- Sings HL, De Wals P, Gessner BD, Isturiz R, Laferriere C, McLaughlin JM, et al. Effectiveness of 13-Valent Pneumococcal Conjugate Vaccine Against Invasive Disease Caused by Serotype 3 in Children: A Systematic Review and Meta-analysis of Observational Studies. Clin Infect Dis Off Publ Infect Dis Soc Am. 30 May 2019;68(12):2135‑43.
- Moberley S, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev. 31 Jan 2013;(1):CD000422.
- Suzuki M, Dhoubhadel BG, Ishifuji T, Yasunami M, Yaegashi M, Asoh N, et al. Serotype-specific effectiveness of 23-valent pneumococcal polysaccharide vaccine against pneumococcal pneumonia in adults aged 65 years or older: a multicentre, prospective, test-negative design study. Lancet Infect Dis. 2017;17(3):313‑21.
- Kim JH, Chun BC, Song JY, Kim HY, Bae I-G, Kim D-M, et al. Direct effectiveness of pneumococcal polysaccharide vaccine against invasive pneumococcal disease and non-bacteremic pneumococcal pneumonia in elderly population in the era of pneumococcal conjugate vaccine: A case-control study. Vaccine. 9 May 2019;37(21):2797‑804.
- Bonten MJM, Huijts SM, Bolkenbaas M, CAPITA Coauthors. Vaccine against Pneumococcal Pneumonia in Adults. N Engl J Med. 2015;373(1):93.
- McLaughlin JM, Jiang Q, Isturiz RE, Sings HL, Swerdlow DL, Gessner BD, et al. Effectiveness of 13-Valent Pneumococcal Conjugate Vaccine Against Hospitalization for Community-Acquired Pneumonia in Older US Adults: A Test-Negative Design. Clin Infect Dis Off Publ Infect Dis Soc Am. 2018;67(10):1498‑506.
- Cromer D, van Hoek AJ, Jit M, Edmunds WJ, Fleming D, Miller E. The burden of influenza in England by age and clinical risk group: a statistical analysis to inform vaccine policy. J Infect. Apr 2014;68(4):363‑71.
Avis court du CIQ nº : | Pneumo / 2019 / 159 |
Date de réception de la demande d'avis : | 22 mai 2019 |
Demandeur : | Geoffroy Denis, CMPSATQ |
Date de production de l'avis : | 15 octobre 2019 |
Avis discuté et approuvé par le CIQ le : | 1er novembre 2019 |
Auteur : Philippe De Wals, Nicholas Brousseau, Maryse Guay, Comité sur l'immunisation du Québec
Collection : Avis courts du CIQ
Date de publication : 9 janvier 2020

