Nitrates, eau potable et santé de l’enfant
 La présence de nitrates dans l’eau souterraine utilisée pour la consommation humaine est de plus en plus souvent rencontrée sur notre planète, en particulier dans les endroits où se pratique une agriculture intensive. Il s’agit donc d’un paramètre pour lequel des normes ou des critères ont été développés par les instances impliquées dans la protection de la santé publique. Les recommandations concernant les nitrates dans l’eau potable ont cependant la particularité d’avoir été élaborées pour prévenir un effet aigu chez les enfants : la méthémoglobinémie. La norme pour l’eau potable au Québec de 10 mg-N/l(a) est similaire aux valeurs rencontrées ailleurs dans le monde.
La présence de nitrates dans l’eau souterraine utilisée pour la consommation humaine est de plus en plus souvent rencontrée sur notre planète, en particulier dans les endroits où se pratique une agriculture intensive. Il s’agit donc d’un paramètre pour lequel des normes ou des critères ont été développés par les instances impliquées dans la protection de la santé publique. Les recommandations concernant les nitrates dans l’eau potable ont cependant la particularité d’avoir été élaborées pour prévenir un effet aigu chez les enfants : la méthémoglobinémie. La norme pour l’eau potable au Québec de 10 mg-N/l(a) est similaire aux valeurs rencontrées ailleurs dans le monde.
La toxicité des nitrates résulte de leur transformation en nitrites. Ces derniers peuvent réagir avec le fer de l’hémoglobine des globules rouges et entraîner la formation subséquente de méthémoglobine. C’est pour prévenir l’apparition de méthémoglobinémie chez le nourrisson que la concentration de 10 mg-N/l de nitrate dans l’eau potable est recommandée.
Une évaluation du risque à la santé pouvant être associé à la présence de nitrates dans l’eau souterraine a été réalisée dans le cadre d’un vaste projet intitulé « Étude sur la qualité de l’eau potable dans les sept bassins versants en surplus de fumier et impacts potentiels sur la santé1. Cette évaluation du risque concernait le risque de méthémoglobinémie chez le nourrisson et le risque de cancer. Dans le cadre d’une réflexion sur l’environnement et la santé de l’enfant, nous allons revoir les grandes lignes de cette évaluation du risque concernant la méthémoglobinémie et faire ressortir des points importants concernant l’évaluation du risque chez les enfants. Le lecteur voulant en apprendre davantage sur le sujet pourra se référer au rapport.
Exposition
Sans aucune influence d’activités humaines, les concentrations de nitrates dans l’eau sont faibles (inférieures à 0,2mg-N/l) et l’exposition se fera principalement par les aliments. Cependant, si les concentrations de nitrates dans l’eau potable excèdent la norme, la contribution de l’eau à la dose totale sera beaucoup plus importante.
Pour les nourrissons, le scénario d’exposition est légèrement différent. Dans le cas des nourrissons alimentés au lait maternisé, l’eau utilisée pour la préparation du lait est la seule source de nitrates. Le lait maternisé peut donc devenir une source importante d’exposition aux nitrates lorsque l’eau utilisée pour sa préparation est contaminée. Pour les nourrissons allaités, l’apport en nitrates est considéré comme négligeable.
Les concentrations de nitrites (responsables de la méthémoglobinémie) sont très faibles dans l’environnement. Toute substance azotée a tendance à se transformer en nitrates puisque ces derniers sont la forme la plus stable dans l’environnement.
Outre les différentes sources externes de nitrates (aliments et eau de consommation), il ne faut pas oublier la production endogène de nitrates. Approximativement 1 mg/kg/j de nitrates serait produit par l’organisme sans qu’il y ait d’apport externe. Cette production est fortement augmentée dans le cas de maladies infectieuses ou inflammatoires, et particulièrement la diarrhée.
Métabolisme
Le métabolisme joue un rôle très important dans la toxicité des nitrates. En effet, les nitrates ingérés sont rapidement absorbés au niveau de l’intestin grêle, dont une partie (soit environ 25 %) est sécrétée dans la salive. La microflore buccale réduit environ 20 % de ces nitrates sécrétés en nitrites. On estime donc qu’environ 5 % des nitrates ingérés seront réduits en nitrites dans la salive.
Une fois absorbés, les nitrates seront éliminés dans les urines avec une demi-vie d’excrétion estimée à 5 heures.
En ce qui concerne les nitrites, bien que l’on ne dispose pas de données sur leur absorption gastro-intestinale, la formation de méthémoglobinémie subséquente nous laisse croire qu’ils sont absorbés. Une fois dans le sang, les nitrites réagiront avec l’hémoglobine pour produire la méthémoglobine. Les nitrites pourraient également réagir avec certains composés aminés (amines, amides, etc.) présents dans l’alimentation pour former une classe de composés nommés composés N-nitrosés, dont certains sont soupçonnés être cancérigènes. Il faut souligner que certaines substances comme la vitamine C et autres antioxydants pourraient inhiber la réaction des nitrites avec l’hémoglobine et les composés aminés et avoir ainsi un effet protecteur.
Méthémoglobinémie
La méthémoglobine est une forme d’hémoglobine dans laquelle le fer est présent sous forme oxydée ou ferrique incapable de transporter l’oxygène. Il existe un niveau physiologique de méthémoglobine de l’ordre de 1 à 2 %(b). La méthémoglobinémie clinique avec cyanose apparaît dès que le taux de méthémoglobine atteint 10 %2.
La méthémoglobinémie provoquée par les nitrates dans l’eau de boisson a principalement été observée chez les enfants de moins de 3 mois. Les nourrissons semblent beaucoup plus susceptibles de développer la méthémoglobinémie en raison des facteurs suivants1:
- La faible acidité gastrique permettant la prolifération des bactéries nitrates-réductrices;
- L’incidence accrue de gastro-entérites favorisant aussi la prolifération de ces bactéries;
- L’hémoglobine fœtale qui prédomine pendant les premiers mois de la vie est particulièrement sensible à l’action oxydante des nitrites;
- Le système enzymatique responsable de la réduction physiologique de la méthémoglobine en hémoglobine est moins efficace chez le nourrisson;
- L’apport en liquide du nourrisson très élevé par rapport à son poids corporel.
Plusieurs cas de méthémoglobinémie associés à la consommation d’eau contaminée par les nitrates ont été rapportés chez les très jeunes enfants. En 1951, Walton3 publiait une enquête réalisée auprès de 47 états américains dans laquelle il répertoriait 317 cas de méthémoglobinémie du nourrisson survenue de 1939 à 1949. Au moins 39 (12,3 %) de ces enfants étaient décédés et la concentration de nitrates était connue dans 214 cas. Dans la grande majorité des cas (80,8 %), la concentration de nitrates détectée dans l’eau était supérieure à 50 mg-N/l. Aucun cas n’a été observé lorsque les concentrations étaient inférieures à 10 mg-N/l et dans seulement 2,3 % des cas, les concentrations de nitrates se situaient entre 11 et 20 mg-N/l. Cette publication est à l’origine des normes et recommandations pour les nitrates dans l’eau potable.
Plusieurs autres études de cas, expérimentales et épidémiologiques, ont été publiées depuis. Toutes ces études concordent pour relier la consommation de nitrates dans l’eau et l’augmentation du taux de méthémoglobine chez les nourrissons. Toutefois, ces augmentations des niveaux de méthémoglobine sont en général faibles et semblent plus fréquentes chez les enfants souffrant de diarrhée. De plus, il semble que les enfants recevant un apport suffisant en vitamine C seraient « protégés ». Il est très difficile d’établir la relation entre les concentrations de nitrates mesurées dans l’eau et les niveaux de méthémoglobine, mais il serait exceptionnel d’observer des cas de méthémoglobinémie clinique à des concentrations inférieures à 20 mg-N/l.
La relation entre l’augmentation des taux de méthémoglobine et la présence de nitrates dans l’eau est cependant contestée. Une des thèses avancées veut que ce soit la contamination microbienne des biberons qui serait responsable de la transformation des nitrates en nitrites à l’intérieur du biberon avant d’être ingérés4. Une deuxième thèse veut que ce soit la présence d’infections gastro-intestinales et l’inflammation qui s’en suit qui activerait la production d’oxyde nitreux responsable de l’apparition de méthémoglobinémie5. Pour leur part, Knobeloch et al6 contestent ces deux théories. Selon eux, des cas de méthémoglobinémie sont apparus sans qu’il y ait contamination microbienne de l’eau, et la majorité des cas de méthémoglobinémie ne sont pas suffisamment documentés pour permettre de conclure qu’il y a toujours présence de gastro-entérite.
Modélisation
Les différentes études réalisées chez l’humain nous démontrent le lien entre les nitrates et l’augmentation de la méthémoglobine. Mais, tel que mentionné précédemment, plusieurs points au niveau des facteurs favorisant ou inhibant la formation de méthémoglobine ou des mécanismes d’action impliqués demeurent inconnus. La réalisation d’une évaluation du risque basée sur un modèle toxicocinétique apparaît être une étape importante dans la compréhension du phénomène. La formation de méthémoglobine étant au point de départ un phénomène physiologique avec ses vitesses de formation et de réparation, l’élaboration d’un modèle toxicocinétique peut nous permettre de décrire les variations de concentrations de méthémoglobine dans le temps.
À partir de ces considérations, nous avons donc élaboré un modèle toxicocinétique pour décrire la variation des concentrations de méthémoglobine dans le temps en fonction d’une dose donnée de nitrates. Il s’agit d’un modèle unicompartimental. Les détails de calcul de ce modèle ne seront pas décrits ici et le lecteur intéressé peut se référer au rapport complet1. Nous discuterons de trois paramètres importants inclus dans le modèle :
- La quantité de nitrites formée à partir des nitrates dans la salive;
- La constante de formation et de réparation de la méthémoglobine;
- Les simulations Monte Carlo.
Quantité de nitrites formés à partir des nitrates dans la salive
Ce point est d’une très grande importance dans l’évaluation du risque de méthémoglobinémie chez les nourrissons, car en absence de formation de nitrites à partir des nitrates il n’y a pas de formation de méthémoglobine. On a l’habitude de considérer que 5 % d’une dose de nitrates ingérée sera transformé en nitrites. Cette valeur dérive d’études dans lesquelles des volontaires ont ingérés une dose connue de nitrates et où les concentrations salivaires de nitrites ont par la suite été mesurées. Pour connaître le bien fondé de cette valeur de 5 % ainsi que la variabilité lui étant associée, une réévaluation de toutes ces études a été réalisée. Les données individuelles de concentrations salivaires de nitrites pour les différentes doses de nitrates présentées dans ces études ont été compilées et les statistiques en découlant calculées.
L’évaluation de ces études a permis de constater qu’aucune d’entre elles n’a été réalisée chez les enfants qui représentent pourtant et de loin, le groupe le plus sensible lorsque l’on s’intéresse à la méthémoglobinémie associée aux nitrates. Les taux de transformation de nitrates en nitrites varient entre les individus : le 10e centile de la distribution a une valeur de 1 %, le 90e 11 %, la moyenne arithmétique 5 % et la moyenne géométrique 3 %.
La constante de formation et de réparation de la méthémoglobine
Il existe peu de données décrivant la cinétique de formation et de réparation de la méthémoglobine à partir des nitrites. Des valeurs de constantes de formation (Ka) et d’élimination (Kel) ont été retrouvées dans la publication de Kirk et al7. Dans cette étude, les auteurs ont suivi les concentrations sanguines de méthémoglobine chez quatre patients ayant reçu du nitrite de sodium pour traiter une intoxication aux cyanures.
Ces données restreintes permettent tout de même de constater qu’il existe une variabilité entre les patients par rapport aux taux de formation et de réparation de la méthémoglobine. Encore une fois, il faut constater que ces données proviennent d’adultes et que celles chez les enfants sont inexistantes. Pour tenir compte du fait que le système de réparation est moins efficace chez les très jeunes enfants, nous avons divisé par deux la valeur de la constante de réparation (Kel) retrouvée dans cette étude.
Simulations Monte Carlo
En plus des paramètres décrits plus haut (quantité de nitrites formés, taux de formation et de réparation de la méthémoglobine), d’autres arguments ont été pris en considération pour construire le modèle toxicocinétique : pois corporel des nourrissons, consommation d’eau, concentration d’hémoglobine dans le sang, concentration de nitrates dans les puits. Dans une population, tous ces paramètres sont variables d’un individu à l’autre, ce qui a pour conséquence logique que pour une concentration donnée de nitrates dans l’eau potable la concentration de méthémoglobine qui en résultera variera d’un nourrisson à l’autre. Les simulations Monte Carlo permettent de reproduire cette variabilité populationnelle. Ainsi, une fois développée, l’équation toxicocinétique décrivant les concentrations de méthémoglobine en fonction des concentrations de nitrates permet d’attribuer une distribution de valeurs pour la majorité des arguments la constituant. Ainsi, en résolvant l’équation grâce aux simulations Monte Carlo, nous obtenons une distribution de concentrations de méthémoglobine pour une population de nourrissons.
Résultats
Dans le cadre du projet intitulé « Étude sur la qualité de l’eau potable dans les sept bassins versants en surplus de fumier et impacts potentiels sur la santé » des concentrations de nitrates ont été mesurées dans des puits utilisés pour la consommation humaine. Le modèle toxicocinétique développé a permis d’évaluer le risque pour les nourrissons des régions à l’étude, de développer une méthémoglobinémie. Les concentrations de nitrates mesurées dans l’étude étaient faibles (87 % des puits présentant des concentrations mesurées de nitrates < 3 mg-N/l). Pour ces concentrations de nitrates, les simulations nous confirment qu’il est peu probable qu’une augmentation des niveaux de méthémoglobine puisse être observée chez les nourrissons de 15 jours à 8 semaines. En effets, le 97,5e centile de la distribution des concentrations de méthémoglobine obtenue résulte en une augmentation de 2 % des niveaux de méthémoglobine et ce, seulement pour les nourrissons âgés de 4 semaines.
Les simulations de Monte Carlo permettent de réaliser une analyse de sensibilité, c’est-à-dire de définir les des paramètres de l’équation étant responsables de la plus grande variabilité du système. Dans le cas présents, une part importante de la variabilité (~70 %) est associée à la concentration de nitrates dans l’eau, suivie par le taux de transformation de nitrates en nitrites (~20 %).
Il est pertinent de se demander quelles sont les augmentations du niveau de méthémoglobine qui pourraient être observées si les concentrations de nitrates dans l’eau étaient supérieures à celles mesurées dans l’étude. L’exercice a été repris pour des nourrissons de 4 semaines en considérant des concentrations de nitrates dans l’eau de 10, 20 ou 36(c) mg-N/l. Nous retrouvons au tableau 1 les concentrations moyennes et maximales(d) de méthémoglobine prévues par le modèle toxicocinétique.
Tableau 1. Distribution des concentrations de méthémoglobine (%) pour des nourrissons de 4 semaines exposés à 3 concentrations différentes de nitrates dans l’eau potable
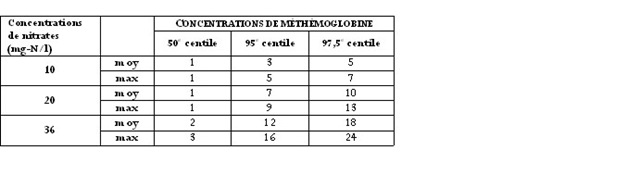
Ce tableau est intéressant du fait que les résultats qui y sont présentés concordent avec ce qui est observé dans les différentes études menées chez l’humain. À une concentration de 10 mg-N/l, le risque de présenter une méthémoglobinémie de plus de 10 % est à peu près nul. Par contre, les nourrissons consommant une eau contenant 20 mg-N/l de nitrates présentent environ 2,5 % de risques d’avoir une méthémoglobinémie de 10%. Ceci correspond relativement bien aux données de la littérature montrant que ce ne sont pas tous les enfants qui développeront une méthémoglobinémie de 10 % à des concentrations de nitrates de 20 mg-N/l. Enfin, à une concentration de 36 mg-N/l, le risque de développer une méthémoglobinémie importante sera plus grand, un nourrisson ayant environ 20 % de risques de développer une méthémoglobinémie supérieure à 10 %.
Discussion
Le modèle toxicocinétique présenté ici constitue un exercice très intéressant et met à notre disposition on outil supplémentaire pour gérer les risques. Ce modèle comporte également des limites et devra être bonifié. Premièrement, il faut mentionner que le modèle ne tient pas compte de la présence possible d’infections chez les enfants, en particulier les diarrhées. Bien que pour l’instant rien ne nous permette de conclure que tous les cas de méthémoglobinémie sont associés aux nitrates chez le nourrisson, nous ne pouvons pas non plus nier son rôle dans le développement de cette pathologie.
Il faudrait également dans de futurs développements tenir compte du rôle protecteur que semble apporter l’apport en antioxydants, en particulier la vitamine C. Cet effet protecteur a plusieurs fois été rapporté dans les études épidémiologiques. D’un point de vue biochimique, cet effet protecteur de la vitamine C est plausible. En effet, au niveau des réactions d’oxydoréduction, la vitamine C a le potentiel de réduire les nitrites et de les rendre ainsi inaptes à réagir avec l’hémoglobine.
Une constatation importante ressortant de l’élaboration de ce modèle est le manque flagrant de données concernant les paramètres associés aux enfants. On constate souvent la pauvreté des banques de données pour la population adulte mais elles sont le plus souvent inexistantes en ce qui concerne les enfants. Pensons par exemple aux taux de transformation de nitrates en nitrites qui est la pierre angulaire de toute évaluation du risque concernant les nitrates. Aucune étude n’a été réalisée à ce sujet chez les enfants. On considère également que le système enzymatique responsable de la réduction physiologique de la méthémoglobine en hémoglobine est moins efficace chez le nourrisson, mais qu’encore une fois, il n’existe aucune donnée permettant de quantifier le phénomène.
Un dernier point méritant d’être souligné est l’apport important que procure l’évaluation du risque au niveau de la compréhension et de la gestion des problématiques en santé environnementale. L’évaluation du risque et le développement de modèle qui y est associé nous permettent de mieux comprendre les mécanismes impliqués, de visualiser l’importance de chacun des paramètres les uns par rapport aux autres et de faire ressortir les points qui méritent d’être étudiés davantage. Ceci est particulièrement vrai lorsqu’on se penche sur la santé des enfants, car ces derniers présentent souvent des systèmes enzymatiques immatures et qui sont moins à même de métaboliser rapidement certaines substances toxiques. Les apports en eau et en aliments sont le plus souvent supérieurs à ceux des adultes sur une base de poids corporel. Par le fait qu'elle cherche à définir tous ces paramètres et bien d’autres, l'évaluation du risque constitue un outil de choix pour traiter ces problématiques.
Références
- Phaneuf D, Chaussé K, Pantako O, Levallois P (2004) Évaluation du risque à la santé pour la population exposée aux nitrates présents dans l’eau potable. Étude sur la qualité de l’eau potable dans les sept bassins versants en surplus de fumier et impacts potentiels sur la santé. Institut national de santé publique du Québec et Unité de recherche en santé publique, Centre de recherche du CHUL (CHUQ) Disponible: www.inspq.qc.ca/pdf/publications/331-BassinsVersantsFumier_Nitrates.pdf
- Levallois P, Phaneuf D (1994). La contamination de l’eau potable par les nitrates : analyse des risques à la santé. Revue canadienne de santé publique 85(3) : 192-6.
- Walton GW, (1951) Survey of the litterature relating to infant methemoglobinemia due to nitrate-contaminated water. Am J Public Health, 41, 986-996.
- L’hirondelle JL (1998) L’innocuité des nitrates alimentaires Médecine/Science 14 :636-9.
- Avery AA (1999) Infantile methemoglobinemia : reexamining the role of drinking water nitrates Environ Health Perspect 107 : 583-586
- Knobeloch L, Salna B, Hogan A, Postle J, Anderson H (2000) Blue babies and nitrate-contaminated well water Environ Health Perspect 108 :675-678.
- Kirk MA, Gerace R, Kulig KW (1993) Cyanide and methemoglobin kinetics in smoke inhalation victim treated with the cyanide antidote kit Ann Emerg Med 22 (3): 1413-1418.
(a) Les concentrations de nitrates sont exprimées ici en équivalent « azote de nitrate ». Les équivalents sont les suivants : 1mg-N/l = 4,43 mg de nitrate NO3/l.
(b) Les concentrations sanguines de méthémoglobine sont le plus souvent indiquées en pourcentage d’hémoglobine transformé en méthémoglobine.
(c) Le choix de 36 mg-N/l repose sur le fait qu’il s’agit de la concentration de nitrates la plus élevée mesurée dans l’étude.
(d) Les concentrations de méthémoglobine dans le sang ne sont pas un phénomène statique et varieront dans le temps en fonction du moment de l’ingestion de l’eau et du processus de réparation.

