Pollution de l’air intérieur par les hydrocarbures aromatiques polycycliques
Y. Bonvalot, Chaire d’analyse et de gestion des risques toxicologiques, Département de santé environnementale et santé au travail, Université de Montréal et Santé Canada, Programme de la sécurité des milieux, Direction de la Santé Environnementale et de la Sécurité des Consommateurs
F. Labrèche, Santé Canada, Programme de la sécurité des milieux, Direction de la Santé Environnementale et de la Sécurité des Consommateurs
G. Carrier, Département de santé environnementale et santé au travail, Université de Montréal
Introduction
Les hydrocarbures aromatiques polycycliques (HAP) sont des composés possédant au moins deux noyaux benzéniques. Ils proviennent principalement de la combustion incomplète de matières organiques et peuvent être d’origine naturelle (incendies de forêts, éruptions volcaniques, décomposition de matières organiques) ou anthropique (chauffage industriel et résidentiel au gaz, au charbon, au pétrole, production d’aluminium, production de pâtes et papiers, incinération, etc.). Ubiquitaires, ils se retrouvent dans l’air, dans les sols et sédiments, ainsi que dans l’eau, les aliments et certains produits de consommation (cosmétiques, bougies, encens). Chez les non-fumeurs non exposés professionnellement aux HAP, la source principale d’exposition est l’alimentation (viande fumée ou grillée, légumes feuillus, graines) (Manahan, 2005; Yu, 2005; Ramesh et al., 2004).
En plus d’émettre des HAP et des HAP halogénés, la combustion du bois à des fins de chauffage résidentiel serait la troisième source d’émission de particules fines au Canada et une source importante de composés organiques volatils dans la région de Montréal (RMQA, 1998; US.EPA, 1993). Au Canada, 400 000 maisons (6 %) seraient chauffées uniquement au bois et plus de 900 000 (14 %) le seraient au moins en partie (NRC, 1994). Selon un sondage téléphonique effectué à Montréal en 1999, 12,5 % des ménages de la région de Montréal-centre brûlent du bois (Labrèche et al., 2000). Les émissions des systèmes de combustion au bois pourraient donc avoir des impacts sur la santé respiratoire des populations exposées, particulièrement en milieu urbain où s’ajoutent d’autres types de polluants.
Parmi la liste des métabolites HAP généralement mentionnés en médecine environnementale (Angerer et al., 2007), le 1-hydroxypyrène (1-OHP), métabolite du pyrène, reste très utilisé tant en milieu professionnel que pour la population générale. Cependant, la contribution prépondérante de l’alimentation et du tabagisme limite l’intérêt du 1-OHP pour départager la contribution de certaines expositions environnementales dans la population générale. Le naphtalène est le principal HAP émis lors de la combustion du bois (US EPA, 1993; Viau et al., 2000), suivi de près par le phénanthrène. Les principaux métabolites urinaires de ces deux HAP pourraient s’avérer des biomarqueurs tout aussi pertinents, si ce n’est plus, que le 1-OHP urinaire, d’autant que ces métabolites ont pu être décelés tant chez des fumeurs que chez des non-fumeurs non exposés professionnellement, et que des différences significatives ont été mises en évidence entre fumeurs et non-fumeurs (Gündel et al., 1996). Si comme pour le pyrène, l’alimentation peut s’avérer une source non négligeable de phénanthrène chez des individus non exposés professionnellement (Hoepfner et al., 1987), ce n’est pas le cas du naphtalène qui serait ainsi beaucoup plus spécifique de la combustion du bois.
L’étude présentée visait à vérifier si l’utilisation de biomarqueurs d’exposition aux HAP est susceptible de confirmer la contribution de la combustion du bois sur l’exposition de la population aux polluants émis.
Matériels et méthodes
Sur l’Île de Montréal, deux zones d’étude ont été définies (une fortement utilisatrice et une autre faiblement utilisatrice de système de combustion au bois) à partir des données d’un sondage réalisé à l’automne 1999 auprès d'environ 8 000 logements montréalais (1 000 utilisateurs et 7 000 nonutilisateurs) (Labrèche et al., 2000).
L’étude s’est déroulée de la mijanvier à la mi-mars 2000, période durant laquelle la température est la plus froide à Montréal. Dans chacune des deux zones, 20 maisons ont été recrutées (40 maisons en tout). Un échantillonnage d’air a été réalisé sur deux périodes non contiguës de 24 heures, les samedis et lundis de chaque semaine, pendant 5 semaines, à raison de huit maisons par journée d’échantillonnage (4 par zone). Les logements potentiels étaient appelés selon un ordre aléatoire et retenus dès que les résidants acceptaient, après vérification du respect des critères d’inclusion (brûlage de bois ou non et consommation de cigarettes à l’intérieur de la maison ou non). Les participants ont tous signé un formulaire de consentement.
Un questionnaire et un journal de bord ont permis de recueillir de l’information sur diverses variables (démographiques, résidentielles, combustibles utilisés, types d’appareil de combustion du bois et habitudes de brûlage du bois, le cas échéant) et de documenter les autres sources de pyrène possibles (alimentation, shampoings, etc.), pour chacune des journées où avaient lieu le recueil des mictions urinaires et l’échantillonnage d’air. Aucune restriction alimentaire ou tabagique n’a été imposée aux participants afin de ne pas altérer les comportements des individus et d’être le plus proche possible de situations réelles et non expérimentales, qui sont davantage transposables à la population générale.
Les 1- et 2-naphtols, de même que le 1-OHP, ont été mesurés dans l’urine des participants (en micromoles/ mole de créatinine et en nanomoles cumulées sur l’échantillon total) par le Centre de toxicologie du Québec par chromatographie en phase gazeuse sur colonne capillaire couplée à un détecteur de masse en mode séquentiel de dépistage d’ions sélectifs (Jansen et al., 1995; Yang et al., 1999).
Résultats
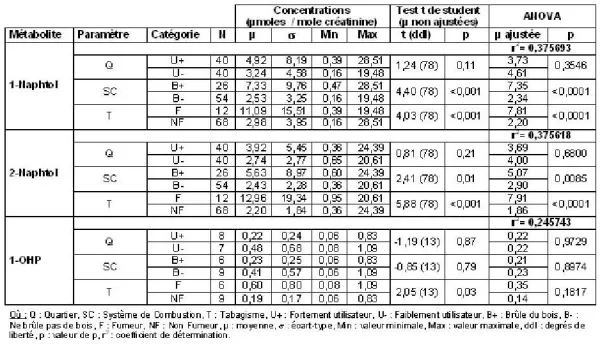
Le tableau 1 rassemble les résultats obtenus pour les 1- et 2-naphtols et le 1-hydroxypyrène en concentrations ajustées sur la créatinine. Les moyennes ajustées sont estimées pour chacun des paramètres du devis de l’étude (quartier, système de combustion au bois, tabagisme) en contrôlant sur les 2 autres paramètres de ce dernier (par exemple, les moyennes ajustées de l’effet « quartier » permettent de contrôler l’influence des effets « système de combustion au bois » et « tabagisme »). Les naphtols (1- et 2-) ont été détectés dans tous les échantillons urinaires recueillis, alors qu’à peine 19 % des échantillons présentaient des niveaux mesurables de 1-OHP.
Tableau 1. Concentrations des métabolites urinaires ajustées sur la créatinine
Après ajustement, les résultats associés à la présence d’un système de combustion au bois et au tabagisme demeurent statistiquement significatifs sur la base des concentrations urinaires pour les 1- et 2- naphtols. Les mêmes résultats sont obtenus sur la base du cumulatif urinaire (nanomoles cumulées) sauf pour le paramètre « système de combustion au bois » dans le cas du 2-naphtol (résultats non présentés). Dans le cas du 1-OHP, quel que soit l’indicateur utilisé (μmoles/ mole de créatinine ou nmoles cumulées), les moyennes, non ajustées ou ajustées, estimées ne présentent aucune différence statistiquement significative entre les groupes.
Conclusion
Les moyennes arithmétiques obtenues sont du même ordre de grandeur que celles observées dans d’autres études, avec des concentrations urinaires moyennes de 1-naphtol de 3,97 μmoles/mole de créatinine, allant de 2,98 μmoles/mole de créatinine chez des non-fumeurs à 11,17 μmoles/ mole de créatinine chez des fumeurs (basé sur 12 échantillons). Les valeurs correspondantes pour le 2-naphtol étaient de 3,62 μmoles/mole de créatinine, soit de 2,22 μmoles/mole de créatinine chez des non-fumeurs et de 12,9 μmoles/mole de créatinine chez des fumeurs.
L’optimisation du recueil des mictions urinaires, qui a eu pour principal effet d’alléger la charge de travail des participants, s’avère être appropriée et les naphtols (1- et 2-), spécifiques de la combustion du bois et d’une exposition dans l’air ambiant, ont été détectés dans 100 % des échantillons recueillis avec une précision acceptable.
L’hydroxypyrène n’apparaît pas être un bio-indicateur approprié dans de telles situations d’exposition environnementale (grande variabilité interindividuelle, apport essentiellement alimentaire). Même un recueil des mictions urinaires « conventionnel » (soit sur 24 heures) n’aurait pu pallier ces limites, augmentant même le risque de perdre des participants.
Cette étude démontre une différence significative dans les niveaux de naphtols urinaires selon le fait d’utiliser ou non un système de combustion du bois et ce, qu’il s’agisse du 1-naphtol (moyenne arithmétique de 2,57 μmoles/ mole de créatinine chez les nonutilisateurs et de 6,87 μmoles/ mole de créatinine chez les utilisateurs, p<0,001), ou du 2-naphtol (moyenne arithmétique de 2,43 μmoles/mole de créatinine chez les non-utilisateurs et de 5,27 μmoles/mole de créatinine chez les utilisateurs, p<0,005). Les concentrations moyennes de naphtols étaient aussi plus élevées, mais de façon non statistiquement significative, entre quartiers fortement et faiblement utilisateur de systèmes de combustion du bois.
Bibliographie
- Angerer J., Ewers U. and Wilhelm M. (2007). Human Biomonitoring: State of the art. Int. J. Hyg. Environ.-Health 210, 201-28. Gündel J., Mannschreck C., Büttner K., Ewers U. and Angerer J. (1996). Urinary levels of 1-hydroxypyrene, 1-, 2-, 3-, and 4- hydroxyphenanthrene in females living in an industrial area of Germany. Arch. Environ. Contam. Toxicol. 31, 585-90.
- Hoepfner I., Dettbarn G., Scherer G., Grimmer G. and Adlkofer F. (1987). Hydroxy-phenanthrene in the urine of nonsmokers and smokers. Toxicol. Lett. 35, 67- 71.
- Jansen E.H.J.M., Schenk E., den Engelsman G. and van de Werken G. (1995). Use of biomarkers in exposure assessment of polycyclic aromatic hydrocarbons. Clin. Chem. 41, 1905-6.
- Labrèche F., Bonvalot Y. et Boivin M.-C. (2000). Enquête téléphonique sur la possession et l’acquisition d’un système de chauffage au bois dans la région de Montréal. Direction de la santé publique, Régie régionale de la santé et des services sociaux de Montréal-Centre, ISBN 2-89494-261-3, 54 pages.
- Manahan S.E. (2005). Environmental chemistry. 8e édition, Boca Raton, CRC Press, 783 pages.
- Ramesh A., Walker S.A., Hood D.B., Maria D. Guillén M.D., Schneider K. and Weyand E.H. (2004). Bioavailability and risk assessment of orally ingested polycyclic aromatic hydrocarbons. Int. J. Tox. 23, 301- 33.
- RMQA – Regroupement Montréalais pour la Qualité de l’Air (1998). Pollution atmosphérique et impacts sur la santé et l’environnement de la grande région de Montréal. Direction de la Santé Publique, Régie régionale de la santé et des services sociaux de Montréal-centre, ISBN 2-89494- 118-8, 355 pages.
- US.EPA – United States Environmental Protection Agency (1993). A summary of the emissions characterization and noncancer respiratory effects of wood smoke. EPA- 453/R-93-036.
- Viau C., Carrier G., Vyskocil A. and Dodd C. (1995). Urinary excretion kinetics of 1- Hydroxypyrene in volunteers exposed to pyrene by the oral and dermal route. Sci. Total Environ. 163, 179-86.
- Viau C., Hakizimana G. and Bouchard M. (2000). Indoor exposure to polycyclic aromatic hydrocarbons and carbon monoxide in traditional houses in Burundi. Int. Arch. Occup. Environ. Health 73, 331-8.
- Yang M., Koga M., Katoh T. and Kawamoto T. (1999). A study for the proper application of urinary naphtols, new biomarkers for airborne polycyclic aromatic hydrocarbons. Arch. Environ. Contam. Toxicol. 36, 99-108.
- Yu M.-H. (2005). Environmental toxicology: biological and health effects of pollutants. 2e édition, Boca Raton, CRC Press, 339 pages.