Les hydrocarbures aromatiques polycycliques : exposition et risques dans la population générale
Les hydrocarbures aromatiques polycycliques (HAP) représentent un groupe de contaminants de l’environnement reconnus prioritaires au Canada1. Ils contiennent au moins deux noyaux benzéniques fusionnés et ne sont formés que de carbone et d’hydrogène2. Les HAP proviennent principalement des processus de pyrolyse et en particulier de la combustion incomplète de la matière organique3. Ils sont également des constituants naturels des huiles de coupe et de plusieurs autres produits pétrochimiques4. Dans l’environnement, ils se retrouvent sous forme de mélanges complexes.
La population générale est exposée aux HAP principalement par l’ingestion de nourriture (en particulier les viandes ou aliments fumés, frits ou cuits sur charbon de bois) et par l’inhalation de fumée de tabac5,6. Les patients psoriasiques se traitant avec des onguents ou des shampoings à base de goudron de houille sont également exposés à des doses particulièrement importantes de HAP7. La contribution de l’air ambiant peut toutefois devenir significative dans les régions industrielles ou dans des secteurs où la circulation automobile est importante8,9. Les sources de HAP dans l’air intérieur, telles que la combustion du bois, du gaz ou du charbon, peuvent également contribuer de façon significative à l’exposition globale aux HAP10,11. Il est à noter que les niveaux d’exposition de la population sont estimés être de 100 à 1 000 fois inférieurs à ceux observés en milieu de travail12.
Plus de 1000 HAP sont susceptibles d’être rencontrés dans l’environnement13. De ce nombre, 26 HAP représentant plus de 90-95 % de la somme des HAP des mélanges sont utilisés pour établir le profil général de ces contaminants14. Douze d’entre eux ont été classés comme cancérogènes probables ou possibles chez l’humain par le Centre international de recherche sur le cancer (CIRC)15,16. Plusieurs mélanges de HAP en milieux de travail ont été également classés comme cancérogènes chez l’humain, leur association avec le cancer du poumon et le cancer de la vessie ayant été démontrée16,18 (Tableau 1).

Parmi les HAP, le benzo(a)pyrène (BaP) est le mieux documenté et le plus mesuré. Le BaP a été classé comme cancérogène probable chez l’humain par le CIRC (groupe 2A) et par le U.S. Environmental Protection Agency (groupe B2), sa capacité d’induire le cancer du poumon chez l’humain étant reconnue15,16,19. Il s’agit d’un procancérogène qui requiert une activation enzymatique pour exercer son effet cancérogène. Il est métabolisé en une vingtaine de métabolites primaires et secondaires oxydés et en une variété de conjugués20. Plusieurs métabolites peuvent réagir avec des macromolécules cellulaires21. Parmi ceux-ci, le BaPDE-I peut se lier de façon covalente à l’ADN et est considéré comme le métabolite cancérogène ultime21.
Surveillance de l’exposition
Surveillance environnementale
Le BaP est souvent utilisé pour exprimer l’exposition globale aux HAP dans l’air. Son poids moléculaire élevé et sa faible pression de vapeur font en sorte qu’il se retrouve habituellement adsorbé en majeure partie à des matières particulaires aéroportées22. Il représente en général 1‑2 % de la somme des HAP de la plupart des mélanges14.
Le phénanthrène, le pyrène et le fluoranthène figurent parmi les HAP présents en plus fortes concentrations dans l’air ambiant peu importe la source d’émission (alumineries utilisant les procédés Söderberg à goujons horizontaux ou verticaux ou le procédé à anodes précuites, usine de carbure de silicium, incinérateurs, circulation automobile, chauffage résidentiel au bois, feux de forêts...)14. Ces HAP de plus faibles poids moléculaires que le BaP, sont largement retrouvés sous forme gazeuse dans l’air ambiant22.
L’apport de la pollution atmosphérique à la dose totale d’exposition en HAP varie en fonction des niveaux de concentration rencontrés dans l’air ambiant. Les HAP atmosphériques s’ajoutent aux HAP provenant des autres sources (tabac, alimentation, eau). L’importance relative de la pollution atmosphérique varie inévitablement selon la présence et l’importance des autres sources d’exposition.
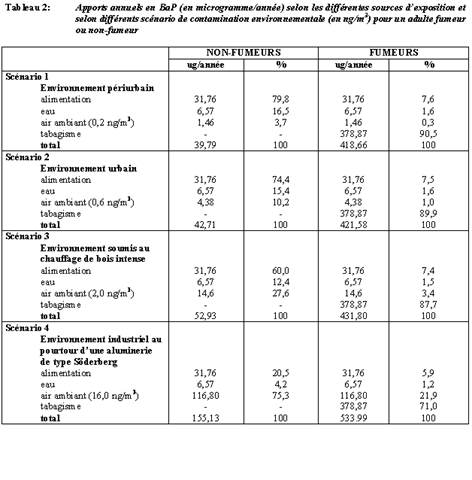
Le tableau 2 présente une estimation de la contribution spécifique des HAP atmosphériques à la dose annuelle totale en BaP chez un adulte fumeur ou non-fumeur et selon différents scénarios de contamination atmosphérique23. Les concentrations de BaP dans l’air ambiant les plus élevées se retrouvent dans les secteurs situés près d’alumineries utilisant le procédé Söderberg. La contribution de la pollution atmosphérique à l’ensemble des sources est plus élevée chez les individus vivant à proximité de ces alumineries, qu’ils soient fumeurs ou non-fumeurs.
Surveillance biologique
Étant donné le potentiel cancérogène du BaP, il apparaît intéressant de recourir à la mesure biologique de ses métabolites. La quantification des adduits à l’ADN (produits de liaison covalente avec l’ADN) dans les globules blancs du sang ou au niveau des tissus cibles, est une approche couramment utilisée pour évaluer l’exposition aux HAP et le risque d’effets cancérogènes24. Elle a l’avantage d’être plus intimement liée aux effets cancérogènes des HAP que la mesure de produits de détoxification dans les matrices biologiques (par exemple, dans l’urine). L’adduit persiste pendant toute la durée de vie de la molécule de liaison soit un à deux ans lorsque lié aux globules blancs sanguins24. La mesure des adduits s’avère donc un bon indicateur de l’exposition passée. Cet outil de surveillance biologique est par contre intrusif et comprend de nombreuses limites, à savoir : 1) la méthode d’analyse est complexe, 2) les adduits à l’ADN sont sujets à de la réparation cellulaire et 3) les cellules cancéreuses se multiplient beaucoup plus rapidement que les cellules saines de sorte que la mesure des adduits au niveau des tissus cibles peut mener à une sous-estimation des concentrations.
La mesure des adduits du BaP aux protéines sanguines, soit l’albumine et l’hémoglobine, est également utilisée pour la surveillance biologique. Cette méthode semble cependant peu sensible pour l’évaluation de l’exposition à de faibles niveaux de HAP25. Comme pour la mesure des adduits à l’ADN, la méthode d’analyse est longue et donc difficilement réalisable en routine. En outre, les échantillons ne sont pas stables à long terme.
Le recours à une mesure urinaire des métabolites du BaP peut également être envisagé. Cependant, étant donné entre autres le poids moléculaire élevé de cette substance, ses métabolites sont principalement éliminés dans les fèces. Afin de parvenir à les quantifier dans l’urine, des méthodes d’analyses extrêmement sensibles doivent être utilisées26,27. En somme, quoiqu’elle s’avère intéressante, cette approche présente de nombreuses contraintes.
À l’inverse, le 1-hydroxypyrène (1-OHP), un métabolite majeur du pyrène chez l’humain, est souvent utilisé pour la surveillance biologique de l’exposition aux HAP. Le pyrène est présent en importante proportion dans la plupart des mélanges de HAP et, contrairement au BaP, il est facilement mesurable dans l’urine humaine même chez des populations témoins. En effet, étant donné son poids moléculaire plus faible, suite à son métabolisme, il est davantage éliminé par excrétion dans l’urine que les métabolites du BaP28. Des méthodes d’analyses simples et sensibles ont par ailleurs été développées. Bien que le potentiel cancérogène du pyrène n’ait pu être mis en évidence dans plusieurs systèmes biologiques15, il a été possible d’établir des corrélations entre les concentrations de HAP totaux ou cancérogènes et celles de pyrène dans divers médias29. Une bonne corrélation entre les concentrations de pyrène dans l’air et le 1-OHP dans l’urine a également pu être établie à partir de mesures en milieu de travail29. De plus, ce bioindicateur est suffisamment sensible pour la surveillance biologique de l’exposition dans la population générale8,9,30.
Risques associés à l’exposition
Risques basés sur les paramètres biologiques
En ce qui concerne les marqueurs biologiques, il n’existe pas de valeur limite d’exposition biologique pour des situations d’exposition à de faibles doses environnementales de HAP. Des indices biologiques d’exposition (IBE) pour le 1-OHP urinaire ont toutefois été proposés pour les travailleurs des alumineries et des fours à coke exposés aux HAP. Ny et coll.31 ont proposé un IBE de 4,3 µmol de 1-OHP/mol de créatinine dans des urines de fin de quart de travail chez des travailleurs de l’industrie de production de l’aluminium utilisant le procédé Söderberg. Jongeneelen et coll.32 ont pour leur part proposé un IBE de 2,3 µmol de 1-OHP/mol de créatinine dans les urines de fin de quart de travail chez des travailleurs de fours à coke.
Afin de statuer sur l’ampleur de l’exposition, les valeurs d’excrétion dans la population en général ou dans des groupes de populations cibles peuvent toutefois être comparées aux valeurs d’excrétion de base dans des groupes témoins non-fumeurs. Les moyennes géométriques de 1‑OHP dans l’urine rapportées dans différentes études québécoises varient entre 0,05 et 0,06 µmol/mol créatinine9,10,33,34. Sur la base de ces dernières valeurs, selon les données de St-Amour et coll.33 chez des individus demeurant à proximité de l’aluminerie de Beauharnois, des niveaux d’exposition de BaP dans l’air ambiant de 1,99 ng/m3 ne se reflètent pas par une augmentation significative de l’excrétion urinaire du 1-OHP.
Risques basés sur les paramètres environnementaux
La préoccupation relative à la présence de BaP dans l’environnement réfère surtout au risque d’apparition de cancer qui y est associé, plus particulièrement à l’égard du cancer du poumon. En ce qui a trait à l’évaluation du risque, on pourrait référer aux pentes dérivées des modèles toxicologiques pour le BaP seul. Toutefois, puisqu’en réalité, l’être humain est exposé à une série d’HAP dont certains présentent aussi un potentiel cancérigène, il est proposé d’évaluer l’ensemble du mélange d’hydrocarbures et de le transformer en équivalent - BaP. Ainsi, le potentiel cancérigène du mélange (d) dépendra de la toxicité relative (Ri) et de la dose de chaque HAP (di) en relation avec le BaP (do): d = j Ridi + do.
À ce jour, on a pu déterminer la toxicité relative d’une vingtaine d’HAP à partir de bio-essais35. Lorsque la charge totale est établie pour le mélange ciblé, on peut d’abord recourir aux pentes des analyses toxicologiques et extrapolées à l’humain (q1*). On propose l’utilisation des pentes dérivées par Neal et Rigdon36 : 3,3 x 10-6 (ng/m3)-1 et par Thyssen et collaborateurs37 : 1,1 x 10‑6 (ng/m3)-1. Le risque individuel à vie (70 ans d’exposition) est alors estimé par la simple multiplication de la pente et de la dose en équivalent – BaP (q1* x d).
Il est également possible d’utiliser les données issues d’une étude épidémiologique récente réalisée chez les travailleurs de l’industrie de l’aluminium exposés à de fortes concentrations d’HAP dans leur milieu de travail38,39. Dans ce contexte, la pente dérivée pour le cancer du poumon est supérieure à celle mesurée lors d’études chez l’animal : 8,5 x 10-5 (ng/m3)-1.
De l’ensemble, on retient qu’en définissant le niveau de risque acceptable à 1 x 10-6 pour la vie, les données issues des analyses toxicologiques situeraient le seuil acceptable pour le BaP entre 0,3 et 0,9 ng/m3. En contrepartie, le seuil dérivé des analyses épidémiologiques se situerait plutôt à 0,01 ng/m3. La différence dans les résultats découlant des deux types d’analyses s’explique possiblement par la présence d’autres cancérigènes dans le mélange d’hydrocarbures dans le milieu de travail, cancérigènes n’ayant pas été pris en compte dans l’analyse épidémiologique à cause de l’insuffisance de données objectives pour les quantifier40.
Idéalement, aux fins de l’analyse de risque, l’ensemble des HAP du mélange devra être pris en compte. L’approche préconisée ici a l’avantage d’être simple. Cependant, la présence possible de nitro-HAP dans l’environnement (NOx+ HAP) complique le débat41. Ces nitro-HAP, une fois nitro-réduits dans l’organisme, génèrent des métabolites dont le pouvoir cancérigène dépasse largement celui des HAP, ceux-là étant identiques aux métabolites des amines aromatiques42. Il est donc opportun de croire que le monitoring environnemental devrait également incorporer certains nitro-HAP comme le 1-nitronaphtalène, le 2-nitronaphtalène, le 4-nitrobiphényle, ce qui ajoute une nouvelle perspective.
Conclusion
Actuellement, il n’existe pas de norme environnementale pour le BaP. Au Québec, on propose un critère de qualité de l’air de 0,9 ng/m343, ce qui est conforme avec la proposition de l’USEPA. Ainsi, le risque à vie pourrait se situer entre 1 x 10-4 et 1 x 10-6 selon l’approche utilisée. L’analyste pourra référer à l’un et l’autre scénario afin d’obtenir une image plus complète, les deux modèles étant basés sur une série d’hypothèses non vérifiables, quantitativement.
Selon l’approche épidémiologique, le seuil en HAP nécessaire pour respecter le risque de cancer habituellement visé par les normes environnementales semble être un objectif non réalisable parce que trop près du bruit de fond. Devant l’importance des risques rencontrés, il demeure néanmoins nécessaire de fixer des objectifs de réduction des émissions. Sans pouvoir prétendre maintenir le risque de cancer à un niveau reconnu acceptable, les résultats des projets de surveillance biologique suggèrent que l’application du critère de qualité proposé pour le BaP à 0,9 ng/m3 permettrait déjà d’éviter que les émissions provenant des alumineries ne représentent une source de surexposition mesurable aux HAP33.
Références
- MEEK, ME, P.K.L. CHAN et S. BARTLETT, 1994. Polycyclic Aromatic Hydrocarbons Evaluation of Risks to Health from Environmental Exposure in Canada. J. Environ. Sci. Health Part C Environ. Carcinogenesis Ecotox. Rev., 12(2) : 443-452.
- LOENING, K., J. Merritt, D. Later et W. Wright, 1990. Polynuclear Aromatic Hydrocarbons. Nomenclature Guide. Battelle Press, Columbus, Ohio.
- NIKOLAOU, K., P. MASCLET et G. MOUVIER, 1984. Sources and Chemical Reactivity of Polynuclear Aromatic Hydrocarbons in the Atmosphere - A Critical Review. Sci. Total Environ., 32 : 103-132.
- LINDSTEDT, G. et J. SOLLENBERG, 1982. Polycyclic Aromatic Hydrocarbons in the Occupational Environment. Scand. J. Work Environ. Health, 8 : 1-19.
- VAN ROOIJ, J.G.M., M.M.S. VEEGER, M.M. BODELIER-BADE, P.T.J. SCHEEPERS et F.J. JONGENEELEN, 1994. Smoking and Dietary Intake of Polycyclic Aromatic Hydrocarbons as Sources of Interindividual Variability in the Baseline Excretion of 1-Hydroxypyrene in Urine. Int. Arch. Occup. Environ. Health, 66 : 55-65.
- DENNIS M.J., R.C. MASSEY, G. CRIPPS, I. VENN, N. HOWARTH et G. LEE, 1991. Factors Affecting the Polycyclic Aromatic Hydrocarbon Content of Cereals, Fats and Other Food Products. Food Additives Contam., 8 : 517-530.
- HANSEN, A.M., O.M. POULSEN et T. MENNÉ, 1993. Longitudinal Study of Excretion of Metabolites of Polycyclic Aromatic Hydrocarbons in Urine from Two Psoriatic Patients. Acta Derm. Venereol., 73 : 88-190.
- OVREBO S., P.E. FJELDSTAD, E. GRZYBOWSKA, E.H. KURE, M. CHORAZY et A. HAUGEN, 1995. Biological Monitoring of Polycyclic Aromatic Hydrocarbon Exposure in a Highly Polluted Area of Poland. Environ. Health Perspect., 103(9) : 838-843.
- GILBERT N.L. et C. VIAU, 1997. Biological Monitoring of Environmental Exposure to PAHs in the Vicinity of a Söderberg Aluminium Reduction Plant. Occup. Environ. Med., 54 : 619-621.
- VIAU C., G. HAKIZIMANA et M. BOUCHARD, 2000. Indoor Exposure to Polycyclic Aromatic Hydrocarbons and Carbon Monoxide in Traditional Houses in Burundi. Int. Arch. Occup. Environ. Health, sous presse.
- ZHAO Z.-H., W.-Y. QUAN et D.-H. TIAN, 1992. Experiments on the Effects of Several Factors on the 1-Hydroxypyrene Level in Human Urine as an Indicator of Exposure to Polycyclic Aromatic Hydrocarbons. Sci. Total Environ., 113 : 197-207.
- VAN ROOIJ, J.G.M., 1994. Dermal Exposure to Polycyclic Aromatic Hydrocarbons Among Workers (Ph.D. Thesis). Katholieke Universiteit Nijmegen, Nijmegen, Netherlands.
- COSTES, J.-M. et V. DRUELLE, 1997. Les hydrocarbures aromatiques polyclicques dans l’environnement: la réhabilitation des anciens sites industriels. Revue de l’Institut Français du Pétrole.
- GERMAIN, A., 1997. Hydrocarbures aromatiques polycycliques - État de la situation au Québec de 1989 à 1994. Environnement Canada, Montréal, 108p.
- IARC, 1987. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. Overall Evaluations of Carcinogenicity: An Updating of the IARC Monographs Vol. 1 to 42, Supplement 7. International Agency for Research on Cancer, WHO, Lyon, France.
- BOFFETTA, P., N. JOURENKOVA et P. GUSTAVSSON, 1997. Cancer Risk from Occupational and Environmental Exposure to Polycyclic Aromatic Hydrocarbons. Cancer Causes Control, 8 : 444-472.
- IARC, 1984. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. Polynuclear Aromatic Compounds. Industrial Exposures in Aluminum Production, Coal Gasification, Coke Production, and Iron and Steel Founding. Vol. 34, part 3. International Agency for Research on Cancer, WHO, Lyon, France, pp 37-183.
- IARC, 1985. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. Polynuclear Aromatic Compounds. Bitumens, Coal-tars and Derived Products, Shale-Oils and Soots. Vol. 35, part 4. International Agency for Research on Cancer, Lyon, France, pp. 39-236.
- DHHS, 1994. Toxicological Profile for Polycyclic Aromatic Hydrocarbons (PAHs). Draft for Public Comment. Update. U.S. Department of Health and Human Services, Public Health Service, Agency for toxic Substances and Disease Registry, Atlanta, Georgia, 273p.
- GELBOIN, H.V., 1980. Benzo(a)pyrene Metabolism, Activation, and Carcinogenesis: Role and Regulation of Mixed-Function Oxidases and Related Enzymes. Physiol. Rev., 60(4) : 1107-1166.
- CONNEY, A.H., 1982. Induction of Microsomal Enzymes by Foreign Chemicals and Carcinogenesis by Polycyclic Aromatic Hydrocarbons: G.H.A. Clowes Memorial Lecture. Cancer Res., 42 : 4875-4917.
- ATKINSON, R. et J. AREY, 1994. Atmospheric Chemistry of Gas-Phase Polycyclic Aromatic Hydrocarbons: Formation of Atmospheric Mutagens. Environ. Health Perspect., 102 (suppl4) : 117-126.
- LAROUCHE, L., 1995. Les hydrocarbures aromatiques polycycliques et le cancer. L’Oncogénèse environnementale au Québec. CSE. Québec.
- DECAPRIO, A.P., 1997. Biomarkers: Coming Age for Environmental Health and Risk Assessment. Environ. Sci. Technol., 31(7) : 1837-1848.
- VIAU, C., A. VYSKOCIL, M. BOUCHARD et G. CARRIER, 1995. La surveillance biologique de l’exposition aux hydrocarbures aromatiques polycycliques. Travail et Santé, 11 : S7-S11.
- ARIESE, F., M. VERKAIK, G.P. HOORNWEG, R.J. VANDENESSE, S.R. UKEMALEENSTRA, J.W. HOFSTRAAT, C. GOOIJER et N.H. VELTHORST, 1994. Trace Analysis of 3-Hydroxy Benzo[a]pyrene in Urine for the Biomonitoring of Human Exposure to Polycyclic Aromatic Hydrocarbons. J. Anal. Toxicol., 18: 195-204.
- JOHNSON, C. et A. GREENBERG, 1999. Extraction and High-Performance Liquid Chromatographic Separation of Selected Pyrene and Benzo(a)pyrene Sulfates and Glucuronides: Preliminary Application to the Analysis of Smokers’ Urine. J. Chromatogr., 728 : 209-216.
- BOUCHARD, M., K. KRISHNAN et C. VIAU, 1998. Kinetics of Tissue Distribution and Elimination of Pyrene and 1-Hydroxypyrene Following Intravenous Administration of 14C-Pyrene in Rats. Toxicol. Sci. 46 : 11-20.
- BOUCHARD, M. et C. VIAU, 1999. Urinary 1-Hydroxypyrene as a Biomarker of Exposure to Polycyclic Aromatic Hydrocarbons: Biological Monitoring Strategies and Methodology for Determining Biological Exposure Indices for Various Work Environments - Review. Biomarkers 4(3) : 159-187.
- ROGGI, C., C. MINOIA, G.F. SCIARRA, P. APOSTOLI, L. MACCARINI, S. MAGNAGHI, A. CENNI, A. FONTE, G.F. NIDASIO et G. MICOLI, 1997. Urinary 1-Hydroxypyrene as a Marker of Exposure to Pyrene: an Epidemiological Survey on a General Population Group. Sci. Total Environ., 199 : 247-254.
- NY, E.T., D. HEEDERIK, H. KROMHOUT, et F. JONGENEELEN, 1993. The Relationship Between Polycyclic Aromatic Hydrocarbons in Air and in Urine of Workers in a Söderberg Potroom. Am. Ind. Hyg. Assoc. J. 54 : 277-284.
- JONGENEELEN, F. J., 1992. Biological Exposure Limit for Occupational Exposure to Coal Tar Pitch Volatiles at Cokeovens. Int. Arch. Occup. Environ. Health, 63 : 511-516.
- ST-AMOUR, M., TREMBLAY, C., JACQUES, L. et WEBER, J.-P., 2000. Surveillance biologique de l’exposition aux hydrocarbures aromatiques polycyliques chez des personnes vivant aux environs d’une aluminerie québécoise. Revue d’épidémiologie et de santé publique, sous presse.
- BOUCHARD, M., L. PINSONNEAULT, C. TREMBLAY et J.-P. WEBER, 2000. Biological Monitoring of Environmental Exposure to Polycyclic Aromatic Hydrocarbons in Subjects Living in the Vicinity of a Creosote Impregnation Plant, soumis pour publication.
- Collins, J.F., Brown, J.F., Alexeeff, G.V., Salmon, A.G., 1998. Potency equivalency factors for some polycyclic aromatic hydrocarbons and polycyclic aromatic hydrocarbon derivatives. Regulatory toxicology and pharmacology 28, 45-54.
- Neal, J., Rigdon, R.H., 1967. Gastric tumours in mice fed benzo(a) pyrene : a quantitative study. Tex. Rep. Bio. Med., 25, 553-557.
- Thyssen, J., Althoff, J., Kimmerle, G., Mohr, U., 1981. Inhalation studies with benzo(a)pyrene in syrian golden hamsters. J. Nat. Cancer Inst., 66, 575-577.
- Armstrong, B., Tremblay, C., Barris, D., Thériault, G., 1994. Lung cancer and polynuclear aromatic hydrocarbons : aluminium production workers in Arvida, Québec. American Journal of Epidemiology, vol. 129, no. 3, 250-262.
- Tremblay, C., Armstrong, B., Thériault, G., Brodeur, J., 1999. Carcinogenic risk assessment of developing lung cancer and bladder cancer following exposure to complex mixture of polycyclic aromatic hydrocarbons (PAHs). Accepté pour publication. Arch. Env. Health.
- Tremblay, C., Armstrong, B., Brodeur, J., Thériault, G., 1995. Estimation of risk of developing bladder cancer among workers exposed to coal tar pitch volatiles in the primary aluminium industry. American Journal of Industrial Medicine, 27 : 335-348.
- Talaska, G., Underwood, P., Maier, A., Lewtas, J., Rothman, N., Jaeger, M., 1996. Polycyclic aromatic hydrocarbons, nitro-PAHs and related environmental compounds : biologic markers of exposure and effects. Env. Health Perspectives. Vol. 104, supp. 5, 901-905.
- Wei, E.T., Shu, H., 1983. Nitroaromatic carcinogens in diesel soot : a review of laboratory findings. AJPH, vol. 73, no. 9, 1055-1988.
- Bisson, M., Walsh, P., 1997. Le benzo(a)pyrène dans l’air ambiant au Québec. Vision Science, 6-9.

