Exposition au manganèse dans l’eau potable et comportements hyperactifs chez des enfants d’âge scolaire
 Introduction
Introduction
Il est maintenant reconnu que l’exposition à certains métaux, tels le plomb et le mercure, interfère avec le développement du système nerveux des enfants. Ces connaissances ont éveillé l’intérêt de la santé publique et conduit à la mise en place de mesures pour réduire l’exposition à ces métaux. Selon de récentes études épidémiologiques et animales, le manganèse (Mn) est un métal qui pourrait aussi avoir des effets néfastes sur le développement neurologique. D’une part, il est connu qu’une petite quantité de manganèse est essentielle au bon fonctionnement de l’organisme et que le risque de carence en manganèse est pratiquement nul, les besoins étant facilement comblés par l’alimentation; un seul cas de déficience induit expérimentalement ayant été rapporté dans la littérature. D’autre part, une surexposition au manganèse, principalement par inhalation, peut causer des effets neurotoxiques.
Les propriétés neurotoxiques du manganèse sont connues depuis 1858, après que le médecin anglais James Couper, ait rapporté l’étrange syndrome d’intoxication dont souffraient des travailleurs de mines de minerai riche en manganèse. Plusieurs de ces mineurs ont en effet développé le manganisme, une atteinte grave du système nerveux central. Il s’agit d’un syndrome progressif et invalidant dont le développement peut être divisé en trois phases :
- La première est une phase précoce où l’on observe une symptomatologie qui n’est pas spécifique. On peut alors observer fatigue, asthénie, apathie, léthargie, faiblesse des membres inférieurs, changement de l’humeur (irritabilité, nervosité, agressivité), anorexie, insomnie ou somnolence, pertes de mémoire, troubles de concentration, douleurs musculaires, arthralgie, céphalées, troubles de la sexualité (libido).
- La seconde phase représente le début de la maladie. On note alors paresthésie, trouble de la parole (ton monocorde, bégaiement) et de la démarche (perte d’équilibre, difficulté à marcher à reculons), légers tremblements, difficulté à écrire, diminution de la dextérité manuelle, faciès figé, instabilité émotionnelle, troubles de la mémoire et du jugement, mouvements lents et maladroits, rires et pleurs incontrôlés. On peut également observer, à ce stade ou au suivant, une psychose maniaco-dépressive (hallucinations, troubles psychiatriques).
- Dans la troisième phase, lorsque la maladie est bien établie, on note une dystonie sévère du tronc et des extrémités; les tremblements lors des mouvements intentionnels sont plus fréquents et sont associés à des mouvements ralentis et plus raides. On peut également observer une démarche hésitante et caractéristique (démarche du coq), une dysphagie, une incoordination motrice, des mouvements musculaires spasmodiques de la musculature crânienne, ce qui peut donner des tics, des grimaces ou le torticolis.
L’exposition au manganèse entraîne une accumulation de ce dernier dans les noyaux gris centraux (structures sous-corticales), et plus particulièrement dans le globus pallidus. L’action toxique du manganèse sur les neurones cause un déséquilibre de l’activité de plusieurs neurotransmetteurs, dont la dopamine et l’acide ã-aminobutyrique (GABA).
Il importe de noter que la vaste majorité des connaissances sur les effets neurotoxiques du manganèse proviennent d’études en milieu de travail. Depuis l’époque de James Couper, de très nombreux cas de manganisme ont été rapportés. Les personnes touchées étaient des travailleurs de différents milieux de travail où des particules aéroportées de manganèse sont présentes en concentration généralement supérieure à 1 mg de Mn/m3, soit des mines et des usines de traitement du minerai de manganèse, des usines de production d’alliages de manganèse, et des endroits où s’effectuent de fréquentes opérations de soudure. Lors d’une plus faible exposition, le risque de manganisme diminue, mais des effets sous-cliniques peuvent être observés. Ces effets peuvent toucher les fonctions motrices (tremblements, difficulté à effectuer des mouvements rapides alternatifs, rigidité musculaire, problèmes posturaux) et cognitives (vitesse de réaction, mémoire, capacité d’attention), et produire des désordres psychologiques (dépression, irritabilité, anxiété, agressivité, confusion).
Exposition à des concentrations élevées de manganèse dans l’eau potable
Si les effets de l’exposition au manganèse par inhalation sont assez bien connus, il en va autrement des effets possibles de l’exposition via l’eau potable. Pourtant, le manganèse peut parfois être présent à des concentrations élevées dans les eaux souterraines, notamment au Québec. Les études menées sur les effets de l’exposition au manganèse par l’eau potable indiquent des risques potentiels pour le système nerveux des enfants. La première d’entres elles, menée en Chine, a montré que des enfants de 11à 13 ans exposés à une eau potable contenant de 241 à 346 µg manganèse/L avaient une mémoire, une dextérité manuelle et une vitesse visuo-perceptive inférieures aux enfants non-exposés1. Les enfants exposés avaient une concentration significativement plus élevée de manganèse dans les cheveux que les non-exposés, et cette concentration était inversement associée aux performances neurofonctionnelles. L’exposition au manganèse était aussi associée à une diminution des concentrations sériques de plusieurs neurotransmetteurs : 5-hydroxytryptamine (5-HT), dopamine, norépinephrine et acétylcholine estérase2. La seconde étude, menée au Bangladesh, indique que la concentration de manganèse dans l’eau était associée négativement au quotient intellectuel chez des enfants de 10 ans3. La concentration de manganèse dans l’eau variait entre 4 et 3 908 µg/L (moyenne: 793 µg/L). Finalement, on a rapporté le cas d’un enfant souffrant de perturbations neurologiques (inattention en classe, faible mémoire mais QI normal, faible habileté à effectuer des mouvements alternés), suivant la contamination du puits familial au manganèse4. Une concentration de 1 200 µg de manganèse/L a été mesurée dans l’eau du puits, et l’enfant présentait aussi une concentration anormalement élevée de manganèse dans le sang, l’urine et les cheveux.
Par ailleurs, une étude a été menée sur les effets de l’exposition au manganèse par ingestion d’eau potable chez des adultes. Au Péloponnèse, en Grèce, trois régions présentant des concentrations croissantes de manganèse ont été comparées : 4 à 15 µg/L (région A), 80 à 250 µg/L (région B) et 1 800 à 2 300 µg/L (région C)5. L’augmentation de la concentration de manganèse dans l’eau était associée à celle dans les cheveux et à des signes neurologiques évalués par un examen standardisé; les différences étaient significatives entre les zones A et C. Notons que la concentration de manganèse dans le sang n’était pas associée à celle dans les cheveux, pas plus qu’aux signes neurologiques. Les résultats de cette étude indiquent que des effets neurotoxiques peuvent se produire à des doses considérées sécuritaires, soit inférieures à la valeur de référence (RfD, 10 mg/jour). Sur la base de cette étude, l’Environmental Protection Agency (EPA) a choisi de considérer avec plus de prudence l’apport en manganèse provenant de l’eau par rapport à celui de la nourriture, en utilisant un facteur de protection de 3 pour évaluer l’apport en manganèse provenant de l’eau potable dans le calcul de la RfD.
Présence de manganèse dans l’eau au Québec
Des concentrations naturellement élevées de manganèse sont retrouvées dans l’eau de plusieurs régions au Québec, au Canada et ailleurs dans le monde. Au Québec, les concentrations sont très variables mais les niveaux les plus élevés sont retrouvés dans les eaux souterraines. On a mesuré des concentrations aussi élevées que 2 800 µg/L dans des puits privés du Lac Brome en Estrie6. Ces hautes concentrations sont favorisées par les conditions oxydo-réductrices qui prévalent dans le sous-sol et qui permettent la dissolution du manganèse des roches. Au Québec, 21 % de la population s’alimente à une source d’eau souterraine mais peu de données sont disponibles sur la présence du manganèse dans les aquifères. La Commission géologique du Canada a mené une enquête dans le bassin versant de la rivière Châteauguay, qui a montré que 10% des puits privés avaient une concentration de 290 µg de manganèse/L7. Si on assume qu’une situation semblable puisse exister dans le reste du Québec, environ 160 000 personnes(a) seraient desservies par une eau ayant minimalement cette concentration de manganèse, concentration ayant été associée, rappelons-le, à des effets néfastes dans l’étude de He et al.1.
Une étude pilote sur l’exposition au manganèse dans l’eau et les enfants8
Au cours de l’année 2005, nous avons été informés que le réseau d’approvisionnement en eau potable d’une municipalité du Québec distribuait une eau avec une concentration élevée de manganèse. Cette information provenait d’un résidant de cette municipalité, aussi étudiant à la maîtrise en sciences de l’environnement à l’Université du Québec à Montréal. Nous avons donc entrepris de mener une étude dans cette municipalité afin de vérifier si des effets néfastes pour la santé pourraient être associés à cette exposition. Les enfants ont été choisis comme population cible à cause de leur possible vulnérabilité aux effets neurotoxiques du manganèse. L’hypothèse de l’étude pilote est que la concentration de manganèse dans l’eau est associée à celle dans les cheveux (indicateur d’exposition), et que cette dernière est associée à des comportements hyperactifs chez les enfants d’âge scolaire de cette municipalité.
Les comportements hyperactifs ont été choisis comme mesure d’effet de l’exposition au manganèse, sur la base d’études portant sur la concentration des éléments traces dans les cheveux chez des enfants présentant des troubles d’apprentissage ou de comportement. En effet, ces études de type cas-témoins ont suggéré un lien entre le manganèse, les difficultés d’apprentissage et l’hyperactivité. Une concentration élevée de manganèse a été mesurée dans les cheveux d’enfants présentant des troubles d’apprentissage9,10 ou identifié comme hyperactifs11,12 par rapport à des enfants ne présentant pas de tels troubles. Cependant, certains problèmes méthodologiques limitent la validité des conclusions qu’il est possible de tirer sur l’implication causale du manganèse, notamment l’exposition à d’autres métaux dont le plomb9 et un groupe contrôle inadéquat11. De plus, le choix d’étudier les comportements hyperactifs reposait sur le fait que ces derniers peuvent être aisément évalués en utilisant des questionnaires administrés aux parents et aux enseignants des enfants, ce qui est commode et peu coûteux.
Pour ce projet pilote, les familles participantes ont été recrutées via les deux écoles de la municipalité, une école primaire et une école secondaire. Au total, 46 enfants âgés entre 8 et 15 ans ont participé à l’étude (24 garçons et 22 filles; âge médian: 11 ans). Le comportement de chaque enfant a été évalué par son enseignant et un parent au moyen de l’échelle révisée de Conners, un questionnaire validé et standardisé (i.e. des normes sont disponibles) fréquemment utilisé en recherche et en clinique au Québec et ailleurs dans le monde13. Les scores ont été calculés pour les quatre échelles suivantes : comportements oppositionnels, comportements hyperactifs, troubles cognitifs/inattention et index. Un échantillon de cheveux a été prélevé sur chaque enfant. La concentration de manganèse a été analysée par le Centre de Toxicologie du Québec (CTQ). Ce dernier propose une étendue de valeur de référence normale pour la concentration de manganèse dans les cheveux de 0 - 3 µg/g, pour des échantillons québécois de cheveux.
Deux puits alimentent les habitations de la municipalité concernée, soit un puits fournissant une eau à 610 µg/L (P1) et l’autre, une eau à 160 µg/L (P2). Dans les deux puits, les concentrations de plomb, d’arsenic et de mercure se sont avérées très faibles (< 0,001 mg/L pour les trois métaux). Vingt-huit enfants (61 %) vivaient dans une maison desservie par le P1, et dix-huit (39 %) dans une maison desservie par le P2. La plupart des parents rapportaient acheter de l’eau en bouteille à cause du mauvais goût de l’eau du robinet. Ainsi, peu d’enfants disaient boire l’eau du robinet (9%), bien que celle-ci ait été utilisée pour la préparation de jus de fruits fait de concentré (11 %), de soupes (59 %) et pour la cuisson d’aliments (96 %). Par contre, le fait de boire l’eau du robinet à l’école, desservie par le P2, était très répandu (89 %).
Les enfants vivant dans les maisons approvisionnées par de l’eau présentant une concentration élevée de manganèse (P1) avaient significativement plus de manganèse dans les cheveux que ceux vivant dans les maisons approvisionnées par le puits à plus faible concentration (moyenne: 6,2 µg/g ± 4,7 versus 3,3 µg/g ± 3,0; p = 0,025). Plus de la moitié (57 %) des enfants avaient des concentrations de manganèse dans les cheveux dépassant la valeur de référence maximale recommandée par le CTQ, soit plus de 3 µg/g. Dans le groupe des enfants exposés à l’eau provenant du puits P1, environ 71 % des enfants avaient une concentration de manganèse supérieure à 3 µg/g, alors que cette proportion était de 33 % chez les enfants exposés à l’eau de P2. La figure 1 présente la distribution cumulée des valeurs de manganèse dans les cheveux en fonction du puits.
Figure 1. Distribution cumulée des valeurs de manganèse dans les cheveux en fonction du puits.
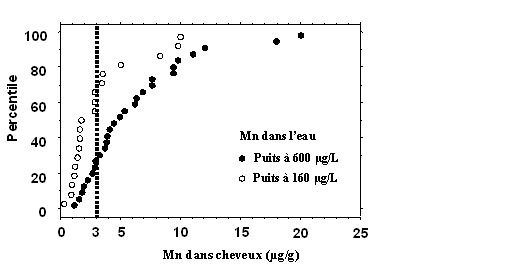
Des analyses de régression ont été utilisées afin d’évaluer l’association entre la concentration de manganèse dans les cheveux et les scores aux quatre sous-échelles du Conners. Après ajustement pour les covariables (âge, sexe et revenu familial), la concentration de manganèse dans les cheveux était significativement associée aux scores de deux échelles du Conners: comportement oppositionnel (p = 0,02) et comportement hyperactif (p = 0,002) (tableau 1). De plus, tous les enfants qui avaient des scores élevés selon le manuel d’utilisation du test aux échelles comportements oppositionnels et comportements hyperactifs, soit 65 (score limite identifiant les enfants qui devraient subir une évaluation clinique), avaient une concentration de manganèse dans les cheveux supérieure à 3 µg/g (tableau 2). Il n’y avait pas de relation significative entre la concentration de manganèse dans les cheveux et les scores au Conners rempli par les parents.
Tableau 1. Résultats des analyses de régression entre la concentration de manganèse dans les cheveux des enfants et les scores aux sous-échelles de l’échelle d’évaluation Conners pour les enseignants.
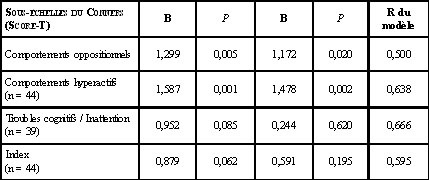
Tableau 2. Distribution des scores-Ta aux sous-échelles de l’échelle d’évaluation Conners pour les enseignants, stratifiée par la concentration de manganèse dans les cheveuxb.
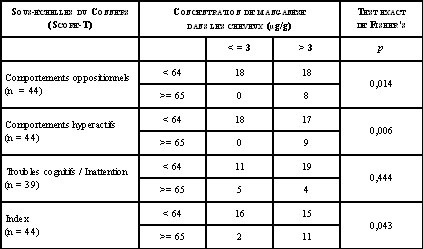
a Point de césure proposé par le manuel du test pour identifier les enfants devant subir une évaluation clinique (Conner, 2000.
b Borne supérieure des valeurs normales (Miekeley et al. 1998)
Les résultats de cette étude pilote suggèrent qu’à une concentration entre 160 et 610 µg de manganèse/L, l’eau peut être une source d’exposition importante à ce métal pour des enfants âgés de 6 à 15 ans. De plus, la relation entre la concentration de manganèse dans les cheveux et des comportements hyperactifs et oppositionnels en classe soulève la possibilité d’un lien causal qui devrait toutefois être établi par des études plus poussées sur cette question. Le résultat le plus frappant de l’étude est que tous les enfants ayant des scores les identifiant pour une évaluation clinique de leurs comportements hyperactifs avaient une concentration de manganèse dans les cheveux supérieure à la valeur recommandée. Bien qu’aucun bioindicateur d’exposition à d’autres métaux n’ait été mesuré, il est peu probable qu’un autre métal neurotoxique (plomb, arsenic ou mercure) puisse expliquer ces observations, puisque des concentrations infimes ont été mesurées dans l’eau.
L’utilisation de cheveux à titre de bioindicateur d’exposition au manganèse n’est pas établi, car les relations entre la concentration de manganèse dans les cheveux et celle dans le sang ou la dose d’exposition sont mal connues. En général, toutefois, on considère que la concentration en métaux dans les cheveux est en équilibre avec le contenu du plasma sanguin qui nourrit la pousse des cheveux. Récemment, d’autres études ont utilisé les cheveux comme bioindicateur d’exposition au manganèse14. De plus, nos résultats ont montré une relation significative entre la concentration de manganèse contenue dans l’eau des puits et la concentration mesurée dans les cheveux, et ceci a également été observé dans d’autres études5,15. À la lumière de ces études, il semble que les cheveux pourraient constituer un bioindicateur d’exposition utile dans l’étude des effets possibles du manganèse sur la santé.
Suite de l’étude
Peu de temps après la fin de l’étude, la municipalité a mis en place un système de traitement par filtration au sable vert afin de diminuer la concentration de manganèse présente dans l’eau. Quatre mois après la mise en place de ce système, un suivi a pu être fait pour 33 des 46 enfants de l’étude initiale. Des échantillons de cheveux ont été prélevés et le Conners a été administré aux parents et aux enseignants. Les résultats montrent que le système de traitement des eaux de la ville est efficace puisque la concentration de manganèse dans l'eau est descendue sous les 30 ug/L. La concentration de manganèse dans les cheveux a aussi diminuée de façon très significative, passant de 4,8 ug/g à 0,68 ug/g; de plus, aucune valeur n’a dépassé les 3 ug/g valeur de référence recommandée par le CTQ. Par ailleurs, il n’y a pas eu de changement significatif dans les scores au Conners. Cependant, les questionnaires ont été complétés par des enseignants différents de l’année précédente, ce qui rend difficile la comparaison des données avant-après la diminution du manganèse dans l’eau.
Aspects règlementaires
Au Canada, les règlements sur la qualité de l’eau potable sont de juridiction provinciale. À ce chapitre, le cadre règlementaire québécois est défini dans le Règlement sur la qualité de l’eau potable. Au Québec, les réseaux d’approvisionnement en eau potable sont principalement opérés par des municipalités, ces dernières ayant également la responsabilité de faire respecter le Règlement. Or, le manganèse ne fait pas partie de la liste des éléments inclus dans le Règlement, ce qui fait en sorte que le ministère du Développement durable, de l’Environnement et des Parcs (MDDEP) n’exige pas qu’il soit mesuré par les exploitants des systèmes de distribution d’eau. Sur la base des inconvénients qu’il cause à la plomberie et les tissus (tâches) ainsi qu’au goût des boissons, Santé Canada a émis une recommandation pour la concentration de manganèse dans l’eau potable de 50 µg/L. Cette recommandation basée sur des considérations organoleptiques n’a pas force de loi, et les exploitants sont libres de l’observer ou non. En se basant plutôt sur les effets possibles sur la santé, l’Organisation mondiale pour la santé propose une valeur limite à 400 µg/L pour le manganèse dans l’eau potable16, alors qu’aux États-Unis, l’EPA établit cette valeur à 300 µg/L17.
Une étude d’envergure sur l’exposition au manganèse par l’eau et la santé des enfants
À la suite des résultats obtenus de cette étude pilote, nous avons entrepris une étude épidémiologique d’envergure sur le sujet. Une subvention des Instituts de recherche en santé du Canada (IRSC) nous a récemment été accordée pour réaliser cette étude, dont l’objectif principal est de tester l’hypothèse selon laquelle l’exposition au manganèse dans l’eau affecte négativement les comportements et les habiletés cognitives et neuromotrices des enfants. Cette étude épidémiologique transversale sera menée auprès d’enfants de quatre municipalités, avec des catégories de concentration de manganèse dans l’eau de l’aqueduc établies comme suit :
- très basse (<50 µg/L)
- basse (~150 µg/L)
- moyenne (~300 µg/L)
- haute (~600 µg/L).
Les familles seront recrutées par le biais des écoles primaires des municipalités ciblées (100 enfants par municipalité); un total de 400 enfants âgés entre 7 et 12 ans seront inclus dans l’étude.
L’évaluation des enfants inclut des tests sur le quotient intellectuel, la mémoire, la capacité d’attention et de concentration, les habiletés visuo-spatiales, les fonctions exécutives, la vitesse motrice et la dextérité manuelle. Les comportements des enfants seront aussi évalués par un parent et un enseignant au moyen de questionnaires. Des informations sur les variables qui pourraient influencer les résultats à ces tests seront également recueillies, dont l’âge, le statut socio-économique, l’environnement familial, l’histoire médicale et les stress périnataux. L’exposition au manganèse par l’eau potable sera évaluée de diverses façons. Un échantillon d’eau sera prélevé dans la maison des enfants participants et la concentration de manganèse et d’une série d’autres métaux seront mesurées. De plus, comme la concentration de manganèse varie beaucoup d’un endroit à un autre d’un réseau d’aqueduc ainsi que dans le temps, une analyse des variations spatiales et temporelles des concentrations de manganèse dans l’aqueduc des quatre municipalités sera réalisée afin de raffiner la mesure de l’exposition. Des données sur la diète et sur la quantité d’eau du robinet ingérée seront récoltées. Ces données serviront à calculer l’apport en manganèse par l’eau et par l’alimentation. De plus, une mèche de cheveux sera prélevée pour l’analyse de la concentration de manganèse et d’une série d’autres métaux.
Les résultats de l’étude proposée pourraient servir de base à une recommandation québécoise pour une concentration maximale de manganèse dans l’eau potable pour la protection de la santé des enfants. L’analyse statistique visera à évaluer: i) l’exposition au manganèse, et ii) la relation entre l’exposition au manganèse et les évaluations neurofonctionnelles (scores aux tests) en tenant compte des covariables. Après avoir identifié les tests pour lesquels des relations dose-réponse sont statistiquement significatives, l’approche benchmark-dose sera utilisée pour déterminer le niveau d’exposition associé à un accroissement du risque de problèmes neurofonctionnels.
Références
- He P, Liu DH, Zhang GQ. (1994). Effects of high-level-manganese sewage irrigation on children’s neurobehavior. Zhonghua Yu Fang Yi Xue Za Zhi 28: 216-8.
- Zhang G, Liu D, He P. (1995). Effects of manganese on learning abilities in school children. Zhonghua Yu Fang Yi Xue Za Zhi 29: 156-8.
- Wasserman GA, Liu X, Parvez F, Ahsan H, Levy D, Factor-Litvak P, Kline J, van Geen A, Slavkovich V, LoIacono NJ, Cheng Z, Zheng Y, Graziano JH. (2006). Water manganese exposure and children’s intellectual function in Araihazar, Bangladesh. Environ Health Perspect 114: 124-9.
- Woolf A, Wright R, Amarasiriwardena C, Bellinger D. (2002). A child with chronic manganese exposure from drinking water. Environ Health Perspect 110: 613-6.
- Kondakis XG, Makris N, Leotsinidis M, Prinou M, Papapetropoulos T. (1989). Possible health effects of high manganese concentration in drinking water. Arch Environ Health 44: 175-8.
- Lajeunesse S. (2004). Exposition orale au manganèse : étude des niveaux de métaux dans l’eau des puits du Lac Brome et de l’ingestion de boissons gazeuses dans le sud-ouest du Québec. Mémoire de maîtrise en science de l’environnement Université du Québec à Montréal.
- Blanchette D. (2006). Caractérisation géochimique des eaux souterraines du bassin versant de la rivière Châteauguay, Québec, Canada. Mémoire de maîtrise Université du Québec, Institut national de recherche scientifique.
- Bouchard, M., Laforest, F., Vandelac, L., Bellinger, D., Mergler, D. (2007). Hair Manganese and Hyperactive Behaviors: Pilot Study of School-Age Children Exposed through Tap Water. Environ Health Perspect 115:122-7. Disponible at: www.ehponline.org/members/2006/9504/9504.pdf
- Pihl RO, Parkes M. (1977). Hair element content in learning disabled children. Science 198: 204-6.
- Collipp PJ, Chen SY, Maitinsky S. (1983). Manganese in infant formulas and learning disability. Ann Nutr Metab 27: 488-94.
- Barlow PJ. (1983). A pilot study on the metal levels in the hair of hyperactive children. Med Hypotheses 11: 309-318
- Crinella FM, Cordova EJ, Ericson J. (1998). Manganese, aggression, and attention deficit hyperactivity disorder (abstract). Neurotoxicology 19: 468–9.
- Conners CK. (2000). Conners’ Rating Scales-Revised: Technical manual Toronto (Canada): Multi-Health System Inc.
- Wright RO, Amarasiriwardena C, Woolf AD, Jim R, Bellinger DC. (2006). Neuropsychological correlates of hair arsenic, manganese, and cadmium levels in school-age children residing near a hazardous waste site. Neurotoxicology 27: 210-6.
- Agusa T, Kunito T, Fujihara J, Kubota R, Minh TB, Kim Trang PT, Iwata H, Subramanian A, Viet PH, Tanabe S. (2006). Contamination by arsenic and other trace elements in tube-well water and its risk assessment to humans in Hanoi, Vietnam. Environ Pollut 139: 95-106.
- WHO. (2006). Guidelines for drinking-water quality, incorporating first addendum. Vol.1, Recommandations. 3rd ed.
- U.S. EPA. (2004). Drinking Water Health Advisory for Manganese. Report 822R04003. Washington, DC.: U.S. Environmental Protection Agency.
(a) Calcul effectué: Population du Québec en 2000 (7 600 000) × proportion de la population s’alimentant à une source en eau souterraine (21%) × proportion des ressources hydriques dont la concentration est supérieure à 290 µg/L (10%).

