Importance de l’exposition à l’acrylamide par l’alimentation chez des adolescents montréalais
Deux articles scientifiques ont découlé de cette étude et sont présentement sous presse :
- Normandin, L., Bouchard, M., Ayotte, P., Blanchet, C., Becalski, A., Bonvalot, Y., Phaneuf, D., Lapointe, C., Gagné, M., CourteauM., (2013). Dietary exposure to acrylamide in adolescents from a Canadian urban center. Food and Chemical Toxicology (2013). dx.doi.org/10.1016/j.fct.2013.03.005.
- Brisson, B., Ayotte, P., Normandin, L., Gaudreau, É., Bienvenu, JF., Fennell, TR, Blanchet, C., Phaneuf, D., Lapointe, C., Bonvalot, Y., Gagné, M., Courteau, M., Snyder, RW., Bouchard, M. (2013). Relation between dietary acrylamide exposure and biomarkers of internal dose in Canadian teenagers. Journal of Exposure Science and Environmental Epidemiology (sous presse).
Dans une perspective de développement et d’innovation, cette étude sur l’acrylamide fait référence à la Programmation scientifique 2012-2015 de l’Institut sur le thème de l’exposition de la population aux contaminants alimentaires.
1 Introduction
1.1 L’alimentation, une source majeure d’exposition de la population générale à l’acrylamide
En 2002, l’acrylamide, une substance cancérogène probable chez l’humain, a été détecté pour la première fois dans plusieurs types d’aliments cuits (EFSA, 2008). Cette substance peut se former dans les aliments d’origine végétale, en particulier les aliments riches en glucides et faibles en protéines, lors des processus de cuisson tels que la friture, la cuisson au four ou au gril et le rôtissage à des températures égales ou supérieures à 120°C (EFSA, 2008). En général, les croustilles de pommes de terre et les pommes de terre frites sont des aliments contenant de fortes teneurs en acrylamide, bien que les concentrations puissent varier considérablement d’un produit à l’autre. Becalski et al. (2003) ont observé que les concentrations d’acrylamide dans les croustilles de pommes de terre et les pommes de terre frites variaient respectivement entre 530 à 3 700 ng/g et 200 à 1 900 ng/g. Les biscuits, les céréales, le pain ainsi que d’autres aliments soumis à des températures élevées, comme les amandes grillées, sont aussi des produits susceptibles de contenir des concentrations variées d’acrylamide (Santé Canada, 2008). L’acrylamide a été également détecté dans le café, les olives noires et les pruneaux (CX/FAC, 2006).
Depuis sa détection dans différents types d’aliments, le Comité mixte FAO/OMS d’experts sur les additifs alimentaires (JECFA) a conclu que l’acrylamide constitue un risque pour la santé humaine (FAO/OMS, 2005). Des études ont donc été réalisées pour caractériser indirectement l’exposition à partir des concentrations mesurées dans les aliments. Les doses moyennes d’acrylamide dans la population générale ainsi estimées variaient de 0,3 à 0,8 μg/kg p.c.-jour (FAO/OMS, 2002).
1.2 Les adolescents : un sous-groupe vulnérable de la population
Selon Dybing et al. (2005), les enfants, les adolescents et les jeunes hommes ont un apport en acrylamide de source alimentaire significativement plus élevé que celui des adultes. L’OMS a indiqué que l’apport d’acrylamide chez les enfants, lorsqu’exprimé en fonction du poids corporel, est généralement le double, voire le triple de celui des adultes (FAO/OMS, 2002). Ce niveau d’exposition plus élevé chez les enfants et les adolescents peut s’expliquer par une ingestion moyenne d’aliments plus élevée par kilogramme de poids corporel que celle des adultes. De plus, Dybing et al, (2005) rapportent que les enfants et les adolescents consomment plus régulièrement certains types d’aliments comme les croustilles de pommes de terre et les pommes de terre frites que le reste de la population.
1.3 Les biomarqueurs d’exposition
Les biomarqueurs d’exposition les plus fréquemment utilisés pour évaluer l’exposition récente de la population à l’acrylamide sont les métabolites urinaires de l’acrylamide. Parmi tous les métabolites, le N–acétylcystéine-S-propionamide (NACP) serait un bon biomarqueur d’exposition (Hays et Aylward, 2008), car il est excrété plus lentement que l’acrylamide et qu’il constitue le métabolite prédominent (Fennell et al., 2006).
L'évaluation de l'exposition passée à l'acrylamide est effectuée en mesurant les adduits que forment l'acrylamide et le glycidamide avec l'hémoglobine. Les adduits N-(2-carbamoyléthyl)valine (AAVal) et N-(2-carbamoyl-2-hydroxyéthyl)valine (GAVal) sont respectivement formés par la réaction de l’acrylamide et du glycidamide, avec la valine N-terminale de l’hémoglobine (FAO/OMS, 2002). Les adduits à l’hémoglobine représentent l'exposition des 4 derniers mois puisque la durée de vie moyenne des érythrocytes est de 120 jours (FAO/OMS, 2002). Ainsi, comparativement aux métabolites urinaires, les concentrations d'adduits reflètent l’exposition sur une plus longue période de temps. Peu d’études ont mesuré à la fois les métabolites urinaires de l’acrylamide et les adduits à l'hémoglobine (Hb) chez les adolescents. Il s’avère donc important de documenter l’exposition de ce groupe de la population exposé à l’acrylamide.
2 Objectifs de l’étude
Cette étude avait pour objectif général d’acquérir des données d’exposition à l’acrylamide auprès d’un groupe d’adolescents montréalais à partir de mesures de biomarqueurs et de vérifier le lien avec la consommation d’aliments pouvant contenir de l’acrylamide.
Les objectifs spécifiques de cette étude étaient les suivants :
- évaluer l’exposition à l’acrylamide d’un groupe potentiellement vulnérable de la population canadienne à partir de mesures de biomarqueurs;
- évaluer les liens possibles entre la consommation d‘aliments pouvant contenir de l’acrylamide et les biomarqueurs d’exposition;
- colliger des données sur l’acrylamide dans les aliments.
3 Méthodologie
Cette étude a été approuvée par les comités d’éthique de la recherche de la Faculté de médecine de l’Université de Montréal et de Santé Canada.
3.1 La population et territoire à l’étude
Un total de 200 adolescents non-fumeurs des 2 sexes, âgés de 10 à 17 ans, ont été recrutés au sein de la population générale de l’Île de Montréal. Le territoire de l’île de Montréal a été sélectionné parce qu’il représente la plus grande région métropolitaine du Québec.
Les individus atteints de certaines pathologies rénales, hépatiques ou de cancer ont été exclus de l’étude lors du recrutement. Ces pathologies peuvent altérer le métabolisme et l’élimination de xénobiotiques. Quatre participants ont été exclus de l’étude, car ils présentaient des valeurs de cotinine urinaire supérieures à 150 µg/l. Cette valeur est le seuil proposé pour départager les fumeurs des non-fumeurs (Galanti, 2008). Un seul participant n’a pas fourni d’échantillon d’urine.
3.2 Le recrutement des participants
Le recrutement aléatoire des adolescents a été effectué par sollicitation téléphonique à partir d’une liste de noms, d’adresses et de numéros de téléphone de résidents de l’Ile de Montréal ou en ligne. Si l’adolescent acceptait de participer, celui-ci était invité à répondre à un questionnaire pour déterminer son admissibilité à participer à l’étude et recueillir des données sociodémographiques. Jusqu’à 2 adolescents par ménage pouvaient être recrutés.
Suite au recrutement, chaque adolescent accompagné par un membre de l’autorité parentale était rencontré par une infirmière afin
- d’expliquer en détail l’étude,
- d’obtenir le consentement écrit de l’autorité parentale et l’assentiment du participant,
- de fournir et d’expliquer comment remplir le journal alimentaire et le questionnaire autoadministré,
- de fournir le contenant et les instructions pour les prélèvements urinaires et
- de fournir un échantillon sanguin.
3.3 Le prélèvement d’échantillons biologiques
Les participants ont fourni une collecte urinaire allant de 18 heures au lendemain matin, en incluant la première miction du matin. Le contenant d’urine était conservé au réfrigérateur des participants jusqu’à ce qu’il soit récupéré puis acheminé au laboratoire pour être aliquoté pour l’analyse éventuelle de l’acrylamide et de ses métabolites urinaires et de la cotinine urinaire.
Des échantillons sanguins ont été prélevés dans des tubes à prélèvement (10 ml, lavande plastique EDTA). Une fois les échantillons prélevés, ils étaient conservés à une température de 4ºC et acheminés au laboratoire où ils étaient traités pour l’analyse éventuelle des adduits de l’hémoglobine.
3.4 Le questionnaire autoadministré : journal alimentaire, alimentation habituelle et habitudes de vie
Les adolescents devaient remplir un questionnaire autoadministré qui était divisé en trois sections.
La première section comprenait le journal alimentaire. Celui-ci documentait, pour une période de deux jours précédant les prélèvements urinaires, la consommation de différentes catégories d’aliments et boissons contenant de l’acrylamide, soit : les céréales, le pain rôti, les frites cuites dans l’huile, les frites cuites au four, les croustilles de pommes de terre, les autres types de croustilles, les bretzels, les craquelins, les olives noires, les biscuits aux brisures de chocolat, le maïs soufflé, les amandes grillées, le café et le jus de prune. Ainsi, pour chacun de ces aliments ou boissons consommés, l’adolescent devait inscrire l’heure de la consommation, la quantité consommée, le nom et la marque de l’aliment ou de la boisson et l’endroit où l’aliment ou la boisson avait été consommé. Cette section servait à évaluer éventuellement l’exposition récente à l’acrylamide.
La seconde section documentait l’alimentation habituelle. Ainsi, pour la période couvrant le mois précédant les prélèvements urinaires, l’adolescent devait indiquer la fréquence de consommation des mêmes aliments ou boissons qui figuraient dans le journal alimentaire. Cette section servait à évaluer éventuellement l’exposition passée à l’acrylamide.
La dernière section du questionnaire portait sur les habitudes de vie. L’adolescent devait préciser son exposition au tabagisme passif, son utilisation de produits de soins personnels, sa consommation d’alcool et déclarer son poids corporel.
3.5 Les échantillonnages des aliments et leur préparation
À partir des réponses inscrites dans le journal alimentaire, un plan d’échantillonnage des aliments et boissons consommés a été établi pour chacune des catégories d’aliments. Le plan d’échantillonnage a porté sur les marques d’aliments les plus consommées, tout en comprenant au moins une marque de chaque catégorie d’aliments. Puisque les teneurs en acrylamide peuvent varier considérablement, et ce, tant dans le même produit que d’un produit à l’autre, le plan d’échantillonnage a été déterminé de manière à prendre en considération à la fois les catégories d’aliments consommées qui contiennent de l’acrylamide et la variabilité dans un même lot et entre les différents lots. Ainsi, un total de 146 échantillons d’aliments ont été achetés dans les supermarchés ou dans les restaurants de la région du Montréal métropolitain pour l’analyse éventuelle des concentrations en acrylamide.
3.6 L’évaluation de l’exposition alimentaire à l’acrylamide
À partir des réponses inscrites dans le journal alimentaire sur les données de consommation, l’apport alimentaire total en acrylamide a été calculé pour chaque aliment consommé. D’abord, le poids en gramme de chaque aliment consommé a été calculé. Lors de la complétion du journal alimentaire, le participant avait la possibilité d’inscrire les quantités consommées sous forme de poids, de volumes ou de modèles de portions alimentaires. Les mesures de volumes et les modèles de portions ont été convertis en poids (grammes), en tenant compte des différences entre les marques des aliments. Ces informations ont permis de mieux préciser les quantités consommées.
Pour l’estimation de l’exposition à l’acrylamide alimentaire, les quantités d’aliments consommées converties en grammes ont été couplées avec les données disponibles sur les teneurs en acrylamide de divers aliments. Ces teneurs provenaient de trois sources : les mesures faites dans le cadre du présent projet, les mesures obtenues de Santé Canada (A. Becalski, communication personnelle) ou des mesures américaines (FDA, 2006a; 2006b). Pour chacun des aliments répertoriés dans les journaux alimentaires des participants, des concentrations d’acrylamide ont été attribuées selon un arbre décisionnel dont la procédure a permis de déterminer la mesure de concentration d’acrylamide la plus probante.
3.7 Analyses de laboratoire
3.7.1 Analyse de la cotinine
La cotinine urinaire, un métabolite de la nicotine retrouvé dans l’urine, a été mesurée par chromatographie liquide à haute performance couplée à la spectrométrie de masse en tandem (HPLC-MS-MS) afin de confirmer que les participants sont des non-fumeurs et seulement exposés à la fumée passive.
3.7.2 Analyse d’acrylamide et de ses métabolites urinaires
L’acrylamide et ses métabolites urinaires, le glycidamide (GA), la N-acétylcystéine-S-propionamide (NACP), la NACP sulfoxyde, la N-acétyl-S-(1-carbamoyl-2-hydroxyéthyl) cystéine (GAMA2), la N-acétyl-S-(3-amino-2-hydroxy-3-oxopropyl) cystéine (GAMA3) et la cystéine-S-propionamide ont été quantifiés dans chacun des échantillons d’urine par chromatographie en phase liquide à ultra performance couplée à la spectrométrie de masse en tandem (UPLC-MS/MS), selon une adaptation des méthodes de Fennell et al. (2005b, 2006).
3.7.3 Analyse des adduits à l’hémoglobine
Les échantillons sanguins ont d’abord été traités afin d’isoler les globules rouges pour le dosage des adduits à l’hémoglobine de l’acrylamide et de son métabolite génotoxique, le glycidamide. Les échantillons de globine ont été analysés selon la méthode de Fennell et al. (2005a) par HPLC-LC-MS équipé d'une source Turbo-ionspray. La quantification de l’AAVal et du GAVal a été réalisée avec une courbe de calibration (AAVal-leu-anilide et GAVal-leu-anilide) et en utilisant le ratio de l’analyte/standard interne.
3.7.4 Mesures des concentrations d’acrylamide dans les denrées alimentaires
Les échantillons d’aliments ont été analysés tels que consommés et leur concentration d’acrylamide a été déterminée par LC-MS/MS selon la méthode de Becalski et al. (2003).
3.8 Le traitement des données et des analyses statistiques
Des analyses descriptives ont été effectuées pour établir la distribution des concentrations de biomarqueurs urinaires et d’adduits à la globine chez les participants (moyenne géométriques ± ET, min, max et centiles). Celles-ci ont été effectuées sur les concentrations non ajustées (µg/l) et ajustées pour le contenu en créatinine (µg/g créatinine). Lorsque les concentrations urinaires de biomarqueurs étaient inférieures au seuil de détection analytique, la moitié de la valeur du seuil était alors attribuée. Cette valeur était ensuite corrigée pour la concentration en créatinine.
Des corrélations de Spearman ont été effectuées pour vérifier la relation entre la fréquence de consommation de certains aliments et les niveaux de biomarqueurs urinaires. La corrélation entre les différents biomarqueurs urinaires a été testée par des corrélations de Pearson (sur les valeurs log transformées). Des analyses multivariées ont également été réalisées afin de mieux caractériser la relation entre les biomarqueurs d’exposition à l’acrylamide et les apports par l’alimentation. Pour l’analyse portant sur les biomarqueurs urinaires, la variable dépendante était la somme des concentrations de deux principaux métabolites d’acrylamide, soit le NACP et le NACP sulfoxyde (µmol/mol de créatinine); la variable indépendante était l’apport moyen en acrylamide (µg/kg PC-j) au cours des deux derniers jours précédant la collecte urinaire. Dans le cas des biomarqueurs sanguins, la variable dépendante était la somme des teneurs d’adduits AAVal et GAVal (pmol/g de globine), tandis que les variables indépendantes étaient les fréquences de consommation des aliments riches en acrylamide durant le dernier mois. Les variables potentiellement confondantes considérées dans les deux modèles étaient l’âge, le sexe, le tabagisme passif (basé sur les niveaux de cotinine : < 6, ≥ 6 et < 30 et ≥ 30 ng/ml), la consommation d’alcool, la scolarité des parents, l’origine canadienne et le type d’école fréquentée. Pour le modèle relatif aux biomarqueurs sanguins, le poids corporel a également été considéré (variable continue en kg).
Des analyses bivariées ont d’abord été réalisées afin d’évaluer les associations entre les facteurs potentiellement confondants et les biomarqueurs d’exposition. Les facteurs associés avec une valeur p < 0,20 ont été retenus dans un premier temps. Par la suite, le facteur dont la valeur p était la plus faible a été entrée dans le modèle et conservé s’il engendrait une variation du bêta de la relation entre l’exposition et le biomarqueur de plus de 10 %. On passait ensuite au facteur suivant selon l’ordre des valeurs p, jusqu’à ce que tous les facteurs ayant passé la première étape aient été testés de cette façon. Les modèles finaux ont été vérifiés pour les problèmes de multicolinéarité et la normalité des résidus. Les analyses statistiques ont été effectuées à l’aide du logiciel SAS version 9.2.
4 Résultats
4.1 Caractéristiques des adolescents
Pour cette étude, 9 filles (48,5 %) et 101 garçons (51,5 %) ont été recrutés. Le taux de participation a été d’environ 2,5 %. Près de 70 % des adolescents étaient au niveau du secondaire, puis la majorité d’entre eux étaient d’origine canadienne (72,4 %) et fréquentaient l’école publique (73,5 %). Plus de 90 % étaient non-fumeurs ou avaient été faiblement exposés à la fumée de cigarette.
4.2 Les teneurs d’acrylamide dans les différentes catégories d’aliments échantillonnés
Les concentrations d’acrylamide varient considérablement d’une catégorie d’aliment à l’autre (< 10 – 2 390 ng/g) et même à l’intérieur d’une même catégorie. Les frites cuites dans l’huile apparaissent comme la catégorie d’aliments contenant le plus d’acrylamide avec une valeur moyenne de 1 053 ng/g. Les croustilles de pommes de terre (valeur moyenne de 524 ng/g) présentent des concentrations moyennes d’acrylamide moins élevées que les frites cuites dans l’huile, mais plus élevées que les frites cuites au four (valeur moyenne de 358 ng/g). Le pain grillé montre en moyenne des concentrations d’acrylamide inférieures à 50 ng/g. Parmi les catégories d’aliments analysées, les olives et le café infusé présentent les plus faibles teneurs d’acrylamide dans les denrées alimentaires; les teneurs d’acrylamide étant inférieures à la limite de détection. Il est à noter que les teneurs en acrylamide mesurées dans les différentes catégories d’aliments échantillonnés ne sont pas présentées en détail ici. Toutefois, le lecteur intéressé à connaitre ces résultats peut se rapport au rapport complet qui sera publié au cours des prochains mois.
4.3 Évaluation de l’exposition alimentaire à l’acrylamide
L’apport alimentaire médian en acrylamide chez les adolescents est de 0,29 µg/kg p.c.-j et chez les grands consommateurs d’aliments pouvant contenir de l’acrylamide (percentile 97,5), l’apport alimentaire est de 2,85 µg/kg p.c.-j.
Les frites cuites dans l’huile contribuent pour 50 % de l’apport alimentaire total. Les croustilles de pommes de terre, avec un pourcentage de 10 %, sont la deuxième catégorie d’aliments qui contribue le plus à l’exposition à l’acrylamide. Les frites cuites au four ne représentent que 8 % de l’exposition. Malgré la forte consommation de pain grillé et de céréales au déjeuner, ces deux catégories d’aliments ne représentent respectivement que 4 % et 8 % de l’exposition totale à l’acrylamide provenant de l’alimentation.
4.4 Les concentrations urinaires de l’acrylamide et ses métabolites
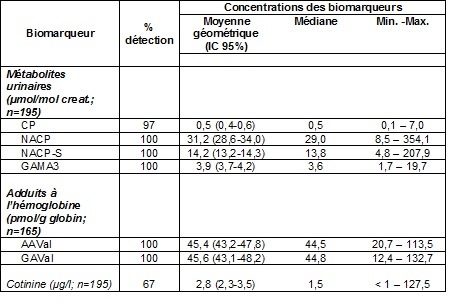
Le tableau 1 présente la distribution des concentrations en acrylamide et de ses métabolites dans l’urine des participants. Les métabolites majoritairement détectés étaient le NACP et NACP sulfoxyde. Les concentrations des autres métabolites suivaient l’ordre : GAMA 3 > cystéine-S-propionamide ≈ acrylamide ≈ Glycidamide.
4.5 Les adduits à l’hémoglobine de l’acrylamide et de la glycidamine
Les résultats des adduits de l’acrylamide (AA-valine) et de la glycidamine (GA-valine) sont présentés au tableau 1. Ces adduits à l’hémoglobine sont détectés et quantifiés dans tous les échantillons sanguins de la population à l’étude. Les valeurs de concentrations de ces deux adduits étaient semblables.
4.6 L’impact du tabagisme
La distribution des concentrations de cotinine dans l’urine des participants est présentée au tableau 1. Parmi les 195 participants, 14 avaient une exposition relativement élevée (≥ 30 ng/ml).
Tableau 1 : Distribution des concentrations urinaires d’acrylamide et de ses métabolites, des adduits à l’hémoglobine de l’acrylamide et du glycidamide et de la cotinine chez les adolescents
4.7 La corrélation entre les biomarqueurs d’exposition
Tous les métabolites urinaires de l’acrylamide sont significativement corrélés entre eux. La plus forte corrélation positive significative a été observée entre le NACP et le NACP sulfoxyde (r = 0,902; p < 0,05). Quant aux adduits à l’hémoglobine, une forte corrélation positive a été observée entre les niveaux d’adduits AA-valine et la GA-valine (r = 0,747; p < 0,05).
4.8 Corrélation entre les biomarqueurs urinaires d’acrylamide et les catégories d’aliments
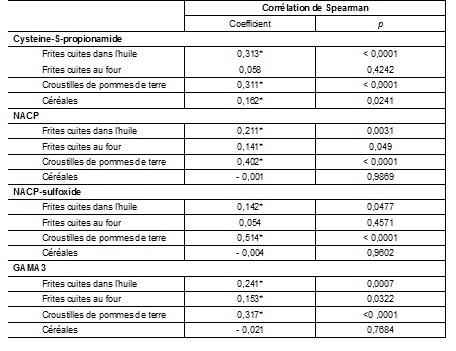
Le tableau 2 présente les corrélations entre les concentrations des métabolites urinaires d’acrylamide et l’apport en acrylamide des différentes catégories d’aliments consommés au cours des deux jours précédant le prélèvement d’urine. Parmi toutes les catégories d’aliments, seuls les apports des frites cuites dans l’huile et des croustilles de pommes de terre sont corrélés positivement et significativement aux concentrations des quatre métabolites urinaires de l’acrylamide. En ce qui concerne le pain grillé, les croustilles de maïs, les craquelins, le maïs soufflé, les biscuits sucrés et les biscuits aux brisures de chocolat, aucune corrélation significative n'a été observée entre l’apport en acrylamide de ces denrées alimentaires et les concentrations des métabolites urinaires de l’acrylamide.
Tableau 2 Corrélations entre les apports découlant de la consommation d’aliments pouvant contenir de l’acrylamide au cours des deux jours précédant le prélèvement urinaire et les concentrations des métabolites urinaires
* p < 0,05
4.9 corrélation entre les biomarqueurs sanguins et les catégories d’aliments
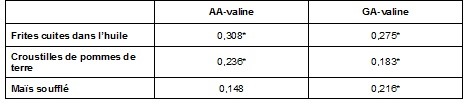
Le tableau 3 présente les corrélations de Spearman entre les biomarqueurs sanguins et la consommation de certaines catégories d’aliments au cours du mois précédant le prélèvement urinaire. Les niveaux d’adduits AA-valine et GA-valine étaient corrélés significativement à la consommation de croustilles de pommes de terre durant le dernier mois précédant le prélèvement. Une corrélation positive significative a également été observée entre la fréquence de consommation de frites cuites dans l’huile et les concentrations de AA-valine et de GA-valine. Une autre corrélation positive a été observée entre la fréquence de consommation de maïs soufflé, les adduits AA-valine et GA-valine, mais l’association n’était significative que pour les adduits GA-valine.
Tableau 3 Corrélation de Spearman entre les biomarqueurs sanguins et la fréquence de consommation de certaines catégories d’aliments au cours du dernier mois
* p < 0,05
4.10 Modèles multivariés des biomarqueurs d’exposition à l’acrylamide
Parmi les facteurs potentiellement confondants considérés lors des analyses bivariées, seuls l'âge et la scolarité des parents étaient assez fortement associés avec la somme des concentrations NACP+NACP sulfoxyde (p < 0,20). Ni l’âge ni la scolarité des parents se sont avérés être des facteurs confondants lorsqu’inclus dans le modèle. Dans le modèle final expliquant 16,6 % de la variance, le coefficient bêta de la relation entre l’apport en acrylamide moyen (log µg/kg PC-j) et la somme NACP+NACP sulfoxyde (log µmol/mol de créatinine) est :
3,0 x10-4 (IC 95 % = 2,0 x x10-4 - 4,0 x10-4) (p < 0,0001).
Le tableau 4 présente le modèle multivarié pour les biomarqueurs sanguins (somme de AAVal + GAVal exprimée en log pmol/g de globine). Les résultats de cette analyse confirment l’apport significatif de la consommation de frites cuites dans l’huile à l’exposition à l’acrylamide de notre groupe d’adolescents. Aucun autre aliment n’est associé positivement au biomarqueur d’exposition sanguin. Nous avons également observé une contribution significative du tabagisme passif à l’exposition à l’acrylamide. Le modèle global explique 21,5 % de la variance de la somme AAVal + GAVal (p < 0,0001).
Tableau 4 Modèle multivarié de la somme des d’adduits AAVal et GAVal à l’hémoglobine (log pmol/g globine) d’adolescents montréalais
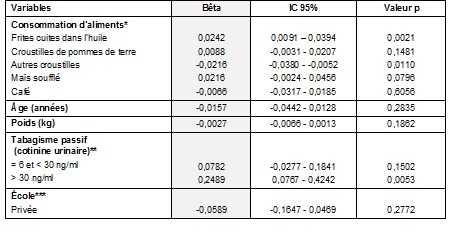
*Catégories de consommation; si une catégorie contenait moins de 5 participants, elle a été fusionnée à la catégorie voisine.
**Catégorie de référence : < 6 ng/ml.
***Catégorie de référence : École publique
5 Discussion
Cette étude de surveillance biologique est la première à utiliser une combinaison de toute une série de biomarqueurs urinaires et d’adduits à l’hémoglobine pour évaluer l’exposition à l’acrylamide chez un groupe potentiellement vulnérable de la population. Elle a confirmé que la consommation d’aliments pouvant contenir de l’acrylamide chez les adolescents augmentait significativement les concentrations de biomarqueurs d’exposition à l’acrylamide. Les concentrations de biomarqueurs urinaires étaient corrélées significativement à l’apport alimentaire en acrylamide et en particulier à la consommation de frites cuites dans l’huile et de croustilles de pommes de terre durant les deux derniers jours précédant la collecte urinaire. L’analyse multivariée des adduits à l’hémoglobine a confirmé l’importance de la consommation de frites cuites dans l’huile comme source d’exposition à l’acrylamide. Elle a aussi permis de mettre en lumière la contribution du tabagisme passif à l’exposition des adolescents à l’acrylamide.
Les biomarqueurs urinaires les plus abondants se sont avérés être le NACP et NACP sufoxyde. Ces biomarqueurs apparaissent les plus pertinents pour la surveillance biologique de l’exposition à l’acrylamide à partir de mesures urinaires. Le GAMA 3 était présent en concentration beaucoup plus faible dans l’urine et donc moins intéressant comme biomarqueur. Les concentrations des adduits AA-valine et GA-valine étaient similaires confirmant l’intérêt de ces deux molécules aux fins de surveillance biologique de l’exposition.
Hartmann et al. (2008) ont mesuré à la fois les métabolites urinaires de l’acrylamide et les adduits à l'hémoglobine chez 11 adolescents allemands âgés de 11 à 18 ans. Les concentrations médianes des métabolites urinaires mesurées du AAMA (ou NACP) et du GAMA étaient respectivement de 44 µg/l (11 - 85) et 15 µg/l (4 - 85). Dans la présente étude, les concentrations urinaires de NACP (tableau 2) sont plus élevées que celle de l’étude de Hartmann et al. (2008). Toutefois, les concentrations du GAMA 3 sont inférieures à l’étude allemande. Par ailleurs, dans Hartmann et al. (2008), les concentrations médianes (étendue) d’adduits à l’hémoglobine de l’acrylamide et du glycidamide étaient respectivement de 34 pmol/g de globine (21 - 71) et 38 pmol/g de globine (14 - 66). Dans notre étude, les concentrations médianes d’adduits à l’hémoglobine pour l’acrylamide et le glycidamide étaient similaires (tableau 2).
Dans le cadre de l’enquête américaine « National Health and Nutrition Examination Survey (NHANES) (2003 - 2004) », les moyennes géométriques d’adduits à l’hémoglobine de l’acrylamide et du glycidamide pour les adolescents américains non-fumeurs étaient respectivement de 52,0 pmol/g de globine et 50,6 pmol/g de globine (Vesper et al., 2010). Ces valeurs sont comparables aux valeurs de la présente étude.
Les apports alimentaires en acrylamide (section 4.3.) observés dans notre étude sont du même ordre de grandeur que l’apport estimé dans différents pays. En 2005, le JECFA a évalué l’apport alimentaire en acrylamide dans 17 pays. Pour la population générale, les apports alimentaires moyens nationaux se situent entre 0,3 et 2,0 µg/kg pc-j. Chez les grands consommateurs (centile 90 à 99), les apports alimentaires estimés sont compris entre 0,6 et 5,1 µg/kg pc-j (JECFA, 2005). Le JECFA (2005) a conclu que l’apport alimentaire moyen pour la population générale était de 1 µg/kg pc-j et celui des grands consommateurs, de 4 µg/kg pc-j.
Par ailleurs, le JECFA (2005) rapporte également que pour la majorité des pays, les frites représentent la catégorie d’aliments qui contribuent le plus à l’apport alimentaire (16-30 %), suivi des croustilles de pommes de terre (6-46 %), du café (13-39 %), des pâtisseries et des biscuits sucrés (10-20 %) et du pain grillé (10-30 %). Les autres catégories d’aliments représentent moins de 10 % de l’apport total. Dybing et al. (2005) rapporte que chez les adolescents belges, l’apport alimentaire des frites contribue pour environ 50 % de l’exposition, ce qui est comparable à notre étude.
De son côté, la FDA rapporte que plus de 80 % de la dose moyenne d’acrylamide ingérée par la population générale provient des huit catégories d’aliments suivantes soit: les croustilles de pommes de terre, les frites tranchées grossièrement, les frites cuites au four, les céréales de petit déjeuner, le pain grillé, les biscuits, le pain blanc et le café (CX/FAC, 2006).
Outre l’alimentation, l’exposition environnementale à l’acrylamide peut être due à la fumée de cigarette, à l’eau potable et à certains cosmétiques. Or, toutes ces sources d’exposition potentielles à l’acrylamide ont été contrôlées dans notre étude.
6 Conclusion
La consommation de frites cuites dans l’huile et de croustilles de pommes de terre représente la majeure partie de l’apport quotidien en acrylamide chez ce groupe d’adolescents de la région de Montréal. Les corrélations significatives observées entre la fréquence de consommation de ces aliments et les biomarqueurs d’exposition confirment la contribution importante de ces aliments à la dose interne d’acrylamide reçue par nos participants. L’apport alimentaire en acrylamide de notre groupe se situe à l’intérieur de la gamme de valeurs rapportées dans différents pays. Les concentrations d’adduits à l’hémoglobine de notre groupe sont également similaires à celles mesurées chez des Américains d’âge comparable.
Références
- Becalski, A., Lau, B.P.Y, Lewis, D. et Seaman, S.W. (2003) Acrylamide in foods: occurrence, sources and modeling. J. Agric. Food Chem. 51: 802-808.
- CX/FAC. 2006. Document de travail sur l'acrylamide - Point 14(g) de l'ordre du jour - 06/38/35. En ligne, consulté le 27 mars 2011. (ftp://ftp.fao.org/codex/ccfac38/fa38_35f.pdf)
- Dybing E., Farmer PB, Andersen M., Fennel TR, Lalljie SP, Muller DJ, Olin S, Petersen BJ, Schlatter J, Scholz G, Scimeca JA, Slimani N, Törnqvist M, Tuijtelaars S, Verger P. (2005) Human exposure and internal dose assessment of acrylamide in food. Food Chem. Toxicol. 43(3) : 365-410.
- EFSA (2008). Autorité européenne de sécurité des aliments. L’acrylamide dans les denrées alimentaires. (www.efsa.eu.int/EFSA/KeyTopics/efsa_locale-1178620753816_acrylamide.htm). Accédé le 24 août 2008.
- FAO/OMS, 2002. Conséquences sanitaires de la présence d’Acrylamide dans les denrées alimentaires – Consultation sur la salubrité des aliments. Rapport d’une consultation conjointe FAO/OMS réunie au Siège de l’OMS, Genève, Suisse, du 25 au 27 juin 2002. (Consulté en ligne le 22 mars 2011) (whqlibdoc.who.int/publications/2002/9242562181.pdf)
- FAO/WHO (2005). Joint FAO/WHO expert committee on food additives. Sixty-fourth meeting. Rome, 8-17 February 2005. (ftp://ftp.fao.org/es/esn/jecfa/jecfa64_summary.pdf ). Accédé le 31 mars 2011.
- FDA (Food and Drug Administration). 2006a. Survey Data on Acrylamide in Food: Individual Food Products. Consulté en ligne le 15 mars 2011. (www.fda.gov/food/foodsafety/foodcontaminantsadulteration/chemicalcontaminants/acrylamide/ucm053549.htm)
- FDA (Food and Drug Administration). 2006b. Survey Data on Acrylamide in Food: Total Diet Study Results. (Consulté en ligne le 15 mars 2011). (www.fda.gov/Food/FoodSafety/FoodContaminantsAdulteration/ChemicalContaminants/Acrylamide/UCM053566)
- Fennell TR, Sumner SC, Snyder RW, Burgess J, Spicer R, Bridson WE, Friedman MA. 2005b. Metabolism and Hemoglobin Adduct Formation of Acrylamide in Humans. Toxicol Sci. 85(1):447-59.
- Fennell, T.R., & Friedman, M.A. (2005a). Comparison of acrylamide metabolism in humans and rodents. Advances in Experimental Medicine and Biology, 561:109-16.:109-116.
- Fennell, TR., Sumner, S.C.J., Snyder, R.W., Burgess, J., Friedman, M.A. (2006). Kinetics of elimination of urinary metabolites of acrylamide in humans. Toxicol. Sci. 93(2): 256-267.
- Galanti, L. (2008). Cotinine urinaire: dosage et applications. La Revue de la Médecine Générale 251: 112-115.
- Hartmann EC, Boettcher MI, Schettgen T, Fromme H, Drexler H, Angerer J. 2008. Hemoglobin adducts and mercapturic acid excretion of acrylamide and glycidamide in one study population. J Agric Food Chem. 13;56(15):6061-8.
- Hays SM, Aylward LL. 2008. Biomonitoring Equivalents (BE) dossier for acrylamide (AA) (CAS No. 79-06-1). Regul Toxicol Pharmacol. 51(3 Suppl):S57-67.
- JEFCA. 2005. Summary and conclusions of the sixty-four meeting of the Joint FAO/WHO Expert Committee on Food Additives, 8-17 February 2005. Disponible au site: www.who.int/ipcs/food/jecfa/summaries/summary_report_64_final.pdf
- Santé Canada (Health Canada). 2008. Aliments et nutrition – Acrylamide et aliments. (www.hc-sc.gc.ca/fnan/securit/chem-chim/food-aliment/acrylamide/acrylamide_and_food-acrylamide_et_aliment-fra.php. Accédé le 22 août 2008.
- Vesper HW, Caudill SP, Osterloh JD, Meyers T, Scott D, Myers GL. 2010. Exposure of the U.S. population to acrylamide in the National Health and Nutrition Examination Survey 2003-2004. Environ Health Perspect. 118(2):278-83.

